Feiba 500 U Iv İnfüzyon İçin Liyofilize Toz Içere... Kullanma TalimatıKan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Kan Koagülasyon (pıhtılaşma) Faktörleri » Anti hemofilik faktor viii KULLANMA TALİMATIFEIBA 500 U IV İnfüzyon İçin Liyofilize Toz İçeren FlakonDamar içine (intravenöz) uygulanır.Etkin madde:Her bir flakon 500 ünite Faktör VIII İnhibitör Baypas Aktivitesinesahip 200-600 mg insan plazma proteini içerir. FEIBA bileşiminde aktive Faktör VII yanında büyük bölümü aktif olmayan formda Faktör II, IX ve X bulunmaktadır. Her bir ünite FEIBA, 0.1 ünite kadar Faktör VIII koagülan antijeni (F VIII C:Ag) içerir. Kallikrein-kinin sisteminin faktörleri ancak eser miktarlarda bulunmaktadır. Yardımcı maddeler:Sodyum klorür, sodyum sitrat, enjeksiyonluk su.Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir. Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz. Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız Bu ilaç kişisel olarak sizin için reçetelendirilmiştir, başkalarına vermeyiniz. Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde bu ilacı kullandığınızı doktorunuza söyleyiniz. Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışındayüksek veya düşükdoz kullanmayınız.Bu Kullanma Talimatında:1. FEIBA nedir ve ne için kullanılır?2. FEIBA'yı kullanmadan önce dikkat edilmesi gerekenler3. FEIBA nasıl kullanılır?4. Olası yan etkiler nelerdir?5. FEIBA'nın saklanması Başlıkları yer almaktadır.1. FEIBA nedir ve ne için kullanılır?FEIBA insan plazmasından yapılmıştır ve kandaki pıhtılaşma faktörlerinin azaldığı ya da olmadığı durumlardaki kanamaları bile durdurur.FEIBA, faktör VIII'e karşı inhibitör gelişmiş hemofili A hastalarında kanamaların tedavisinde kullanılır. FEIBA, faktör VIII'e karşı inhibitör gelişmiş ve baypas ajanı kullanımını gerektirmiş ya da yaşam kalitesinde önemli bozulmaya yol açmış ciddi bir kas-iskelet sistemi kanaması geçirmiş ve/veya yaşamı tehdit eden boyutta bir kanaması olmuş hemofili A hastalarında kanamaları önlemek için de kullanılır. Ek olarak FEIBA faktör VIII'e karşı inhibitör gelişmiş kalıtsal hemofilisi olmayan hastalardaki kanamaların tedavisinde de kullanılabilir. 2. FEIBA'yı kullanmadan önce dikkat edilmesi gerekenlerBilinen bir alerjiniz var ise doktorunuzu bilgilendiriniz.Düşük sodyum diyeti almakta iseniz doktorunuzu bilgilendiriniz. FEIBA'yı aşağıdaki durumlarda KULLANMAYINIZ Eğer FEIBA'nın içerdiği maddelerden herhangi birine karşı alerjiniz (aşırı duyarlılığınız) varsa. Eğer sizde yaygın damar içi pıhtılaşma durumu varsa (Disemine İntravasküler Koagülasyon ya da DIC olarak da adlandırılan ve yaşamı tehdit eden bu hastalıkta kan, damarlar içinde aşırı pıhtılaşır. Bu durum daha sonra tüm vücuttaki pıhtılaşma faktörlerinin tüketilmesine neden olur). Aşağıdaki durumlarda FEIBA yalnızca uygun pıhtılaşma faktörü konsantreleri kullanılarak yapılan tedaviye yanıt alınamadığında (örneğin çok yüksek bir inhibitör titresi varlığına bağlı olarak) kullanılabilir. 1. Kesin bir karaciğer hasarını gösteren laboratuvar sonuçlarının ve/veya klinik belirtilerin bulunması: aktive olmuş pıhtılaşma faktörlerinin vücuttan temizlenmeleri geciktiğinden dolayı bu tür hastalarda yaygın damar içi pıhtılaşma (DIC) gelişmesi riski artmıştır. 2. Miyokard enfarktüsü, aniden kan damarları içinde pıhtı oluşumu (akut tromboz) ve/veya oluşan bu pıhtıların daha küçük damarları tıkaması (embolizm): bu hastalarda FEIBA yalnızca yaşamı tehdit eden kanamalarda kullanılmalıdır. FEIBA'yı aşağıdaki durumlarda DİKKATLİ KULLANINIZFEIBA, insan plazmasından (kanın sulu kısmı) elde edilmiştir. İnsan plazmasından elde edilen ürünler hastalığa neden olacak şekilde virüs ya da diğer enfeksiyon etkenlerini içerebilirler. Alınan tüm önlemlere rağmen, bu tür ilaçların hastalık bulaştırma potansiyeli vardır ve insan kanı ya da plazmasından elde edilmiş ilaçların kullanımında enfeksiyon etkenlerinin bulaşmasına bağlı enfeksiyonların oluşmayacağı tümüyle garanti edilemez. Bu durum, bugüne kadar tanımlanmamış hastalık oluşturucu etkenler için de geçerlidir.- Yapılan laboratuvar testlerinin sonuçlarının ve/veya klinik belirtilerin sizde kesin olarak yaygın damar içi pıhtılaşma olduğunu göstermesi (Disemine İntravasküler Koagülasyon ya da DIC olarak da adlandırılan ve yaşamı tehdit eden bu hastalıkta kan, damarlar içinde aşırı pıhtılaşır. Bu durum daha sonra tüm vücuttaki pıhtılaşma faktörlerinin tüketilmesine neden olur). - Karaciğerinizin hasarlı olması: aktive olmuş pıhtılaşma faktörlerinin vücuttan temizlenmeleri geciktiğinden karaciğer işlevleri bozulmuş hastalarda DIC gelişmesi riski artmıştır. - Kalp hastalığınız olması, aniden kan damarları içinde pıhtı oluşumu (akut tromboz) ve/veya oluşan bu pıhtıların daha küçük damarları tıkaması (embolizm) Yukarıda bahsedilen bu durumlarda doktorunuz FEIBA'yı yalnızca uygun pıhtılaşma faktörü konsantreleri kullanılarak yapılan tedaviye yanıt alınması beklenmediğinde (örneğin çok yüksek bir inhibitör titresi varlığına bağlı olarak) ve yaşamı tehdit eden bir kanamanız varsa (örneğin bir travma ya da ameliyat sonrası kanamanız varsa) kullanacaktır. - Damar içine uygulanan herhangi bir plazma kaynaklı üründe olduğu gibi, alerjik tipte aşırı duyarlılık reaksiyonları görülebileceğinden, alerjik tipteki tepkileri olur olmaz tanıyabilmeniz açısından aşağıdaki aşırı olası duyarlılık reaksiyonlarının erken belirtileri konusunda uyanık olmalısınız: - Eritem (deride kızarma) - Deri döküntüsü - Deride yaygın kabarıklıklar oluşması (kurdeşen) - Tüm vücutta kaşıntı - Dudak ve dilde şişme - Solunum zorluğu / zorlu soluk alıp verme (dispne) - Göğüste sıkışma hissi - Genel bir keyifsizlik durumu - Baş dönmesi/sersemlik hali - Tansiyonunuzda düşme Bu belirtilerden herhangi birini farkederseniz uygulamayı durdurarak hemen doktorunuza başvurunuz. Bu belirtiler anafilaktik şok denilen bir durumun erken habercileri olabilir. Ağır belirtilerin acil tedavisinin yapılması gerekir. Bu ilaca ya da bileşimindeki maddelerden herhangi birine aşırı duyarlı olduğunuzdan kuşkulanılmışsa doktorunuz sizde FEIBA'yı ancak bu ilaçtan beklenen fayda ile bu ilacı yeniden kullanmanızın ve/veya diğer koruyucu tedaviler veya alternatif tedavi edici ajanları kullanmanızın oluşturacağı riski dikkatle karşılaştırarak uygulayacaktır. - Kan basıncınızda ya da kalbinizin atım hızında önemli değişiklikler olursa, solunum zorluğu çekerseniz, öksürük veya göğüs ağrınız olursa uygulamayı hemen durdurarak doktorunuza başvurunuz. Doktorunuz, uygun tanısal yöntemleri kullanarak tedavinizi yapacaktır. - İnhibitör gelişmiş hemofili hastasıysanız ya da pıhtılaşma faktörlerine karşı sonradan kazanılmış inhibitörleriniz varsa. FEIBA tedavisi alan bu tür hastalarda hem kanamaya hem de damar içinde pıhtılaşmaya (tromboz) eğilim artabilir. FEIBA tedavisi sırasında kan damarları içinde pıhtı oluşumu ve oluşan bu pıhtıların daha küçük damarları tıkamasına bağlı olarak aralarında yaygın damar içi pıhtılaşma (DIC), toplardamarlarda pıhtı birikimi, akciğer damarlarının tıkanması (pulmoner embolizm), miyokard enfarktüsü (kalp krizi) ve inme dahil bazı olumsuzluklar görülebilir. FEIBA'nın yüksek dozlarıyla tedavide bu tür olayların riski artmaktadır. İnsan kanı ya da plazmasından hazırlanan tıbbi ürünlerin kullanımından kaynaklanan enfeksiyonların önlenmesi için alınan standart önlemler arasında, donörlerin seçimi, bireysel bağışların ve plazma havuzlarının belirli enfeksiyon göstergeleri için takibi ve virüslerin inaktivasyonu/uzaklaştırılması için etkili üretim aşamalarının kullanılması yer almaktadır. Buna rağmen insan kanı ya da plazmasından hazırlanan tıbbi ürünler uygulandığında, enfeksiyon ajanlarının bulaşma olasılığı tam olarak ortadan kaldırılamayabilir. Bu durum henüz bilinmeyen ya da yeni ortaya çıkan virüsler ve diğer hastalık etkenleri için de geçerlidir. Alınan önlemlerin HIV, HBC, HCV gibi zarflı virüslerle HAV gibi zarfsız virüsler için etkili olduğu düşünülmektedir. Alınan önlemlerin Parvovirüs B19 gibi bazı zarfsız virüsleri uzaklaştırmak ya da inaktive etmek için etkisi ise kısıtlıdır. Parvovirus B19 virüsü en ciddi olarak gebe kadınları (fetusda enfeksiyona neden olabilmektedir), immün yetmezlikli hastaları veya artmış eritrosit döngüsü olan hastaları (örn. hemolitik anemi durumu) etkilemektedir. Düzenli olarak/tekrarlayan dozlarda insan plazması kaynaklı faktör VIII inhibitörü ürünleri alıyorsanız doktorunuz Hepatit A ve B'ye karşı aşılanmanızı önerebilir. Kullanmış olduğunuz ürünlerin bir listesini tutabilmeniz açısından kullandığınız her FEIBA dozundan sonra ürünün adı ve parti numarasını kaydetmeniz önemle önerilmektedir. FEIBA'nın yiyecek ve içecek ile kullanılmasıFEIBA'nın yiyecek ve içecekler ile etkileşimi yokturHamilelikİlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.FEIBA'nın hamilelerde kullanımıyla ilgili klinik deneyim bulunmamaktadır. Hamilelikte pıhtılaşma eğiliminin artmasından dolayı, FEIBA tedavisine ancak başka bir tedavi seçeneği bulunmadığı zaman başvurulmalı ve tedavi yakından izlenmelidir. Bu nedenle gebeyseniz veya gebe olabileceğinizi düşünüyorsanız ilacı kullanmadan önce doktorunuza bildiriniz. Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınızEmzirmeİlacı kullanmadan önce doktorunuza ya da eczacınıza danışınızFEIBA emziren annelerde kullanılmamalıdır.Araç ve makine kullanımıAraç ve makine kullanım becerisi üzerine FEIBA'nın etkisi bilinmemektedir. Araç ve makine kullanırken dikkatli olunmalıdır.FEIBA'nın içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgilerFEIBA flakonunda yaklaşık 80 mg sodyum (hesaplanmış değer) içerir. Bu durum, kontrollü tuz diyetinde olan hastalar için göz önünde bulundurulmalıdır.Diğer ilaçlar ile birlikte kullanımıReçetesiz alınan ilaçlar, aşılar ve bitkisel ilaçlar da dahil olmak üzere başka herhangi bir ilaç almayı planlıyorsanız, alıyorsanız veya yakın zamanda aldıysanız lütfen doktorunuza bildiriniz.Bazı kanama durdurucu ilaçların (epsilon-amino kaproik asit gibi) FEIBA ile bir arada uygulanması önerilmez. Her iki ilacı da almanız gerektiği durumlarda, iki ürünün uygulanması arasında en az 6 saatlik bir süre olmalıdır. Tüm kan pıhtılaşma ürünlerinde geçerli olduğu gibi, FEIBA'nın da uygulamadan önce başka ilaçlarla karıştırılması etkinliğini ve ilaca tahammülünüzü bozabilir. Uygulama diğer ilaçların da ortak olarak uygulandığı bir venöz setten yapılıyorsa, FEIBA uygulamadan önce ve sonra bu uygulama setinin, fizyolojik tuzlu su gibi uygun çözeltilerle yıkanması önerilmektedir. Eğer reçeteli ya da reçetesiz herhangi bir ilacı ş u anda kullanıyorsanız veya son zamanlarda kullandınız ise lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.3. FEIBA nasıl kullanılır?Uygun kullanım ve doz/uygulama sıklığı için talimatlar:Doktorunuz hastalığınıza bağlı olarak ilacınızın dozunu belirleyecek ve size uygulayacaktır. Doktorunuz size uygulanacak dozu ve uygulamanın hangi sıklıkta yapılacağını bireysel olarak belirlemek için sizdeki pıhtılaşma bozukluğunun şiddetini, sizdeki kanamanın nereden ve ne şiddette olduğunu ve sizin genel durumunuzu dikkate alacaktır.FEIBA'yı her zaman için doktorunuzun söylediği şekilde kullanınız. Emin olmadığınız her durumda doktorunuza ya da eczacınıza danışınız. Doktorunuz size uygulanacak dozu ve uygulamanın hangi sıklıkta yapılacağını sizdeki pıhtılaşma bozukluğunun şiddetini, sizdeki kanamanın nereden ve ne şiddette olduğunu ve sizin genel durumunuzu dikkate alarak size özgü olarak belirlemiştir. Doktorunuzca belirlenmiş bu dozajı değiştirmeyiniz ve kendisine sormadan uygulamaya son vermeyiniz. Uygulama yolu ve metodu:FEIBA, ambalajı içindeki çözücüsü ile sulandırıldıktan sonra damar içine (intravenöz) uygulanır. İlacınız doktorunuzun size uygun gördüğü doza bağlı olarak, vücut ağırlığınızın her bir kilogramı başına dakikada 2 üniteden hızlı olmayacak bir sürede damardan uygulanacaktır.Gerekirse uygulama öncesi ürün oda sıcaklığı veya vücut ısısına getirilmelidir. FEIBA, kullanmadan hemen önce sulandırılarak uygulanır. Koruyucu madde içermediğinden sulandırılarak kullanıma hazır hale getirilmiş çözelti hemen kullanılmalıdır. Bütün içerik çözünene kadar yavaşca çalkalayınız. FEIBA'nın tamamen çözünmüş olduğundan emin olunmalıdır; aksi takdirde cihazın filtresinden daha az etkin madde geçer. Sulandırıldıktan sonra bulanık olan ya da tortu içeren çözeltiler kullanılmamalı ve uygun bir şekilde imha edilmelidir. Ambalajı açılmış ürün yeniden kullanılmamalıdır. Yalnızca ambalajı içindeki steril enjeksiyonluk su ve cihazı kullanarak sulandırınız. Ambalajı içindeki cihaz dışında başka bir cihazla kullanılacaksa, en az 149 pm çaplı uygun bir filtre kullandığından emin olunuz. Steril bariyeri bozulan, ambalajı hasar görmüş ya da bozulma belirtisi gösteren ürünü kullanmayınız. Uygulamayı yapacak sağlık personeli için ilacınızı hazırlama ve uygulama talimatı bu Kullanma Talimatı'nın sonunda yer almaktadır. Değişik yaş grupları:Çocuklarda kullanımı:6 yaş altı çocuklardaki kullanımıyla ilgili deneyim yetersizdir. Çocuklarda klinik duruma göre erişkinlerdeki aynı doz şeması doktorunuzca belirlenecektir.Yaşlılarda kullanımı:Y aşlılarda özel kullanım durumu yoktur.Özel kullanım durumları:Karaciğer fonksiyon testleri bozulmuş olan hastalarda aktive olmuş pıhtılaşma faktörlerinin vücuttan temizlenmesinin gecikmesinden dolayı yaygın damar içi pıhtılaşma (DIC) gelişimi riski artar.Eğer FEIBA 'nın etkisinin çok güçlü veya zayıf olduğuna dair bir izleminiz var ise doktorunuz veya eczacınız ile konuşunuz.Kullanmanız gerekenden daha fazla FEIBA kullandıysanız:Kullanmanız gerekenden daha fazla FEIBA kullandıysanız sizde yan etkilerde artış görülebilir.FEIBA 'dan kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuş unuzFEIBA'yı kullanmayı unutursanız:Unutulan dozları dengelemek için çift doz almayınız.FEIBA ile tedavi sonlandırıldığındaki oluşabilecek etkiler:Bulunmamaktadır.4. Olası yan etkiler nelerdir?Tüm ilaçlar gibi FEIBA'nın içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.Aşağıdaki yan etkiler FEIBA kullanılarak gerçekleştirilen klinik çalışmalar ya da FEIBA uygulanmış hastalarda görülmüş yan etkilerdir. Mevcut verilerle ne sıklıkta görüldükleri bilinmemektedir. Bu yan etkilerden herhangi birini fark ederseniz, hemen doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz. - Yaygın damar içi pıhtılaşma (DIC) - İnhibitör düzeylerinde yükselme (anamnestik yanıt) - Aşırı duyarlılık reaksiyonları - Anafilaksi tepkileri - Kurdeşen (tüm vücutta kaşıntılı kabarıklıklar) - Kollar ve bacaklarda hissizlik - Hissizlik ya da anormal his (parestezi) - İnme (pıhtı tıkamasına bağlı felç durumu) - Baş ağrısı - Uykuya meyil - Baş dönmesi / sersemleme - Tat alma bozukluğu - Kalp krizi (Miyokard enfarktüsü) - Kalbin normalden hızlı çalışması (taşikardi) - Damar içinde pıhtı oluşumu ve bu pıhtıların damarları tıkaması - Tansiyonunuzda düşme - Tansiyonunuzda yükselme - Yüz ve boyunda kızarma - Damar içinde oluşan pıhtıların akciğerlerdeki damarları tıkaması - Soluk yollarının daralması - Hırıltılı solunum - Öksürük - Zorlu soluk alıp verme (dispne) - Kusma - İshal - Karında rahatsızlık hissi - Bulantı - Yüzde hissizlik - Yüzde, dilde ve dudaklarda şişme - Kaşıntı - Deri döküntüsü - İlacın uygulandığı bölgede ağrı - Genel keyifsizlik hali - Sıcaklık hissi - Titreme - Ateş - Göğüs ağrısı - Göğüste rahatsızlık hissi - Kan basıncında düşme Hızlı intravenöz infüzyon kan basıncında bir düşme yanında bıçak saplanır gibi bir baş ağrısı ile yüzde ve bacaklarda hissizliğe neden olabilir. Maksimum günlük dozun üzerindeki dozların kullanımından ve/veya uzun süreli uygulamalardan sonra ve/veya tromboembolik olaylar açısından risk faktörü olan hastalarda miyokard enfarktüsü gözlenmiştir. Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız doktorunuzu veya eczacınızı bilgilendiriniz.5. FEIBA'nın saklanmasıFEIBA'yı çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.FEIBA'yı 25°C'nin altındaki oda sıcaklığında saklayınız.Dondurmayınız.Kutusu içinde ışıktan korunmuş şekilde saklayınız. Çevreyi korumak amacıyla kullanmadığınız FEIBA'yı şehir suyuna veya çöpe atmayınız. Bu konuda eczacınıza danışınız.Son kullanma tarihiyle uyumlu olarak kullanınız.Kutu üzerinde yazan son kullanım tarihinden sonra FEIBA 'yı kullanmayınız.Ruhsat sahibi:Eczacıbaşı-Baxter Hastane Ürünleri Sanayi ve Ticaret A.Ş.Cendere Yolu, Pırnal Keçeli Bahçesi 34390 Ayazağa-İSTANBUL Üretim yeri:Baxter AG, Viyana AvusturyaBu kullanma talimatı en sontarihinde onaylanmıştırTedavi koagülasyon bozuklukları konusunda uzman bir hekim tarafından başlatılmalı ve bu hekimin gözetiminde devam ettirilmelidir. Dozaj bilgileri Uygulanacak dozun miktarı, zamanlaması, uygulamanın ne kadar tekrarlanacağı ve tedavinin süresi, kanamanın şiddeti, yeri ve yayılımı yanında hastanın klinik durumuna göre değişir. Dozaj ve uygulama sıklığı her olguda klinik etkililiğe göre ayarlanmalıdır. Genel olarak 50-100 Ünite/kg FEIBA dozu önerilmektedir; kanama şiddetinin daha yüksek doz kullanımını gerektirmediği durumlarda tek uygulamada 100 Ünite/kg ve günlük olarak 200 Ünite/kg dozları aşılmamalıdır. Hastaya özgü faktörler nedeniyle baypas edici ajanlara yanıt değişiklik gösterebilir ve belirli kanama durumlarında bir ajana yetersiz yanıt veren hastalar bir başka ajana yanıt verebilir. Baypas edici bir ajana yanıtın yetersiz olduğu durumlarda, başka bir ajanın kullanımı düşünülmelidir. 1) Spontan kanamalar Kas eklem ve yumuşak doku kanamaları: Küçük ve orta dereceli kanamalarda önerilen doz 12 saatlik aralarla 50-75 Ünite/kg'dır. Tedaviye, ağrının kaybolması, eklem şişkinliğinin azalması ya da hareketliliğinin kazanılması gibi klinik düzelme belirtileri görülene kadar devam edilmelidir. Retroperitonal kanama gibi büyük kas ve yumuşak doku kanamalarında önerilen doz 12 saatlik aralıklarla 100 Ünite/kg'dır. Mukoza kanamaları: Hasta dikkatle izlenerek (kanama bölgesi görülerek, hemotokrit ölçümleri tekrarlanarak) 6 saatte bir 50 Ünite/kg önerilir. Kanama durmazsa, günde 200 Ünite/kg'nin üzerine çıkmamaya dikkat edilerek doz 100 Ünite/kg'a yükseltilebilir. Diğer ciddi kanamalar: Merkezi sinir sistemi kanamaları gibi ciddi kanamalarda 12 saatlik aralıklarla verilen 100 Ünite/kg dozu önerilir. Bazı hastalara FEIBA, belirgin klinik düzelme görülene kadar 6 saatlik aralarla uygulanabilir. Günlük en yüksek doz olan 200 Ünite/kg'lık doz aşılmamalıdır. 2) Cerrahi girişimler Cerrahi girişimlerde başlangıç dozu olarak ameliyat öncesinde 100 Ünite/kg'lık bir doz ve ameliyattan 6-12 saat sonra 50-100 Ünite/kg'lık bir doz uygulanabilir. Postoperatif idame dozu olarak 6-12 saat aralıklarla 50-100 Ünite/kg'lık dozlar uygulanabilir; doz aralıkları ve ameliyat öncesi ve sonrası tedavinin süresi, uygulanan cerrahi girişime, hastanın genel durumuna ve bireysel olarak hastada sağlanan klinik etkinliğe göre belirlenir. - Yüksek inhibitör titresine sahip ve başarısız olmuş ITI (İmmün tolerans tedavisi) sonrası sık kanamaları olmuş hastalarda veya ITI düşünülmeyen hastalarda kanama profilaksisi: Günaşırı 70-100 Ünite/kg'lık bir doz önerilmektedir. Duruma göre doz günde 100 Ünite/kg'a yükseltilebilir ya da giderek azaltılabilir. - Yüksek inhibitör titresine sahip hastalarda ITI (immün tolerans tedavisi) almaktayken görülen hastaların profilaksisi: FEIBA, faktör VIII inhibitör titresi <2 BU* (Bethesda Unit) oluncaya kadar günde iki kez 50-100 Ünite/kg dozunda ve faktör VIII uygulamasıyla eş zamanlı olarak kullanılabilir. * 1 Bethesda Ünitesi inkübe edilmiş (37°C'de 2 saat) plazmanın faktör VIII etkinliğinin %50'sini inhibe eden antikor düzeyi olarak tanımlanmıştır. 4) FEIBA'nın özel hasta gruplarında kullanımı Faktör VIII inhibitörlerinin tam ve kalıcı olarak eliminasyonunu sağlamak için FEIBA, Faktör VIII konsantreleri ile kombine olarak uzun süreli tedavilerde de kullanılmıştır. Tedavinin izlenmesi FEIBA'nın etki mekanizmasının kompleks olmasından dolayı etkin maddenin doğrudan izlemi gerçekleştirilemez. Tam kan pıhtılaşma zamanı (WBCT), tromboelastogram (TEG, r değeri) ve aPTT değerlerinde genellikle ancak az bir azalma görülür ve klinik etkililik ile korelasyon göstermeyebilir. Bu nedenle FEIBA tedavisinin izlenmesinde bu testlerin önemi düşüktür. Tek uygulamada 100 Ünite/kg'lık ve günlük olarak 200 Ünite/kg'lık dozlar aşılmamalıdır. 100 Ünite/kg'lık dozların uygulandığı hastalar dikkatle, özellikle de DIC ya da akut koroner iskemi semptomlarının gelişimi açısından izlenmelidir. Yüksek dozlarda FEIBA ancak kesin olarak gerektiği süre boyunca - kanama durana kadar - kullanılmalıdır. Kan basıncı ile kalp atım hızında klinik olarak anlamlı değişiklikler, solunum zorluğu, öksürük ya da göğüs ağrısı ortaya çıkarsa infüzyon derhal durdurulmalı, uygun tanı ve tedavi metodları uygulanmalıdır. Fibrinojen düzeylerinde bir azalma olması, trombosit sayısında bir azalma olması ve/veya fibrin/fibrinojen yıkım ürünlerinin (FDP) ortaya çıkması DIC açısından anlamlı laboratuvar parametreleridir. Diğer DIC göstergeleri arasında trombin zamanı, protrombin zamanı ve aPTT'nin açık bir şekilde uzaması bulunur. İnhibitörlü hemofili hastalarında veya faktör VIII, faktör IX ve/veya faktör XI'e karşı kazanılmış inhibitörü olan hastalarda aPTT altta yatan hastalığa bağlı olarak uzayabilir. İnhibitörlü hastalarda FEIBA uygulanması başlangıçta inhibitör düzeylerinde anamnestik bir yükselmeye yol açabilmektedir. FEIBA uygulamaya devam edildiğinde, inhibitörler zamanla azalabilir. Klinik ve yayınlanmış veriler FEIBA'nın etkililiğinin azalmadığını öngörmektedir. FEIBA tedavisi uygulanan inhibitörlü hemofili hastalarında veya koagülasyon faktörlerine karşı kazanılmış inhibitörleri olan hastalarda aynı zamanda kanamaya eğilim ve tromboz riski artabilir. Laboratuvar testleri ve klinik etkililik Etkililiğin kanıtı olabilecek aPTT, tam kan pıhtılaşma zamanı (WBCT) ve tromboelastogram (TEG) gibi in vitro testlerle klinik tablonun korelasyon göstermesi şart değildir. Bu nedenle bu değerleri normale döndürmek için FEIBA dozu arttırılmamalıdır; aksine olası bir aşırı doza bağlı DIC olayını tetikleyebilme riski nedeniyle kesinlikle dozun arttırılmaması gerekir. Trombosit sayısının önemi FEIBA'nın etkili olabilmesi için hastada yeterli sayıda ve fonksiyonel olarak sağlam trombosit bulunması gerektiğinden FEIBA ile yürütülen tedaviye yanıt yetersizse bir trombosit sayımı yapılması önerilir. Faktör IX inhibitörü olan hemofili B hastalarındaki deneyim kısıtlıdır. Faktör IX inhibitörü olan hemofili B hastalarındaki kanama ataklarının tedavisinde ve profilaksisinde FEIBA kullanılan 40 vaka raporu bulunmaktadır. Bu 40 hastadan 3'ünde tedavi sırasında anafilaktik reaksiyon bildirilmiştir. FEIBA'nın faktör X, XI ve XIII'e karşı kazanılmış inhibitörleri olan hastalarda kullanımıyla ilgili izole raporlar da bulunmaktadır. Uygulama şekliÜrünü aşağıda tarif edildiği şekilde sulandırarak kullanıma hazırlayınız ve intravenöz yoldan yavaş infüzyon yoluyla uygulayınız.Liyofilize flakonun BAXJECT II Hi-Flow cihaz kullanılarak sulandırılması:1. Gerekliyse çözücü (enjeksiyonluk su) içeren açılmamış flakonu oda sıcaklığına (15 °C -25 °C) kadar ısıtınız. Bu işlem için bir kaç dakika süreyle ılık su banyosu (maksimum 37°C) kullanılabilir. 2. Konsantre ve çözücü flakonlarının koruyucu kapaklarını çıkarınız ve her ikisinin de lastik tıpalarını dezenfekte ediniz. Flakonları düz bir yere yerleştiriniz. 3. BAXJECT II Hi-Flow cihazının ambalajını, ambalajdaki kağıt kapağı çekerek cihazın içine dokunmadan açınız (Şekil a). Cihazı, ambalajın içinden çıkarmayınız. 4. Ambalajı ters çeviriniz ve şeffaf plastik delici kısmını çözücü flakonun tıpasına uygulayınız (Şekil b). Ambalajı kenarından tutarak BAXJECT II Hi-Flow cihazının üzerinden çıkarınız (Şekil c). BAXJECT II Hi-Flow cihazının üzerindeki mavi kapağı çıkarmayınız. 5. Çözücü flakon ve BAXJECT II Hi-Flow cihaz kombinasyonunu, çözücü flakon yukarıya gelecek şekilde çeviriniz. Diğer mor renkli plastik delici ucu, toz konsantrenin bulunduğu flakonun tıpasına uygulayınız. Çözücü vakum etkisiyle konsantrenin bulunduğu flakonun içerisine çekilecektir (Şekil d). 6. Bütün içerik çözünene kadar yavaşça çalkalayınız. FEIBA 'nun tamamen çözünmüş olduğundan emin olunmalıdır; aksi takdirde, etkin madde cihazın filtresinden geçmeyeçektir. 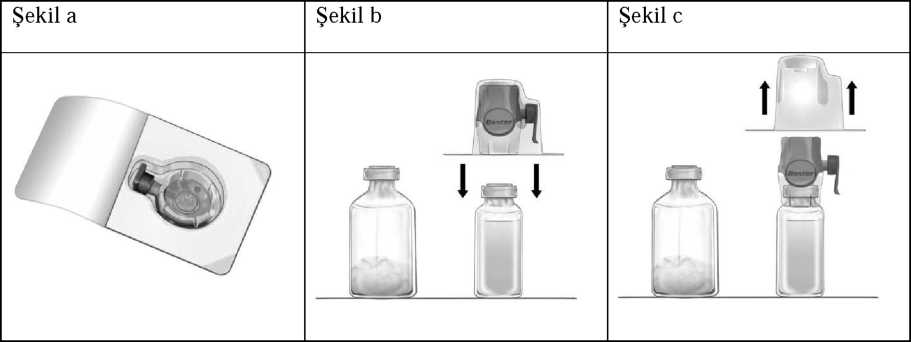
Enjeksiyon / İnfüzyon için talimatlar:1. BAXJECT II Hi-Flow cihazındaki mavi kapağı çıkarınız. Enjektörü BAXJECT II Hi-Flow cihazına iliştiriniz (ENJEKTÖRE HAVA ÇEKMEYİNİZ) (Şekil e). 2. Bileşkeyi ters çeviriniz (FEIBA flakonu üstte kalacak şekilde). Pistonunu yavaşça geriye doğru çekerek FEIBA çözeltisini enjektöre çekiniz (Şekil f). 3. Enjektördeki çözeltiyi kelebek infüzyon seti (ya da tek kullanımlık iğne) ile yavaşça intravenöz enjeksiyon şeklinde uygulayınız. Dakikada maksimum infüzyon hızı her kilogram için 2 ünite'yi aşmamalıdır.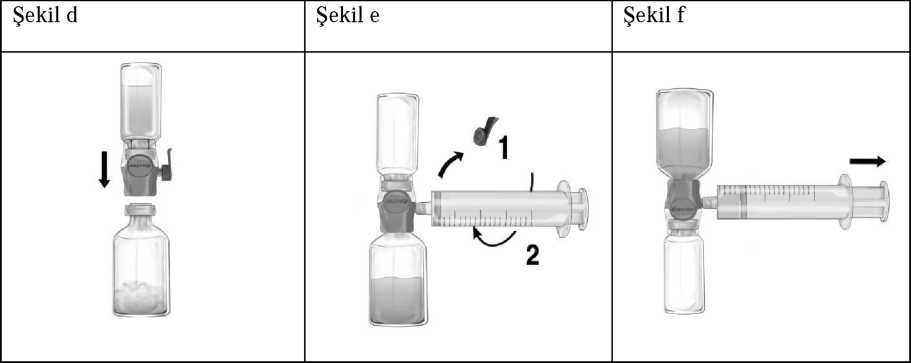 11
11 |
İlaç BilgileriFeiba 500 U Iv İnfüzyon İçin Liyofilize Toz Içere...Etken Maddesi: Faktör Viii Inhibitör By-pass Aktivitesine Sahip ... Atc Kodu: B02BD03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.