Eligard 45 Mg Enjeksiyonluk Çözelti İçin S.c. Toz İçeren Şırınga ve Çözücü İçeren Şırınga Kullanma TalimatıKULLANMA TALİMATIELIGARD® 45 mg enjeksiyonluk çözelti için s.c. toz içeren şırınga ve çözücü içeren şırınga SterilDeri altına uygulanır. Etkin madde:41,7 mg leuproreline eşdeğer miktarda 45 mg leuprorelin asetatŞırınga A: ELIGARD 45 mg'ın rekonstitüsyonu için 434 mg steril çözücü içerir.Şırınga B: 59.2 mg leuprorelin asetat içerir. 434 mg çözücü ile karıştırıldıktan sonra 45 mg/birim elde edilir. Yardımcı madde(ler):85:15 Poli (DL-laktik-ko-glikolit), N-metil-2-pirolidonBu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz. Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız. Bu ilaç kişisel olarak sizin için reçete edilmiştir, başkalarına vermeyiniz. Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde bu ilacı kullandığınızıdoktorunuza söyleyiniz. Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışındayüksek veya düşükdoz kullanmayınız.Bu Kullanma Talimatında:1. ELIGARD nedir ve ne için kullanılır?2. ELIGARD 'ı kullanmadan önce dikkat edilmesi gerekenler3. ELIGARD nasıl kullanılır?4. Olası yan etkiler nelerdir?5. ELIGARD'ın saklanmasıBaşlıkları yer almaktadır.1. ELIGARD nedir ve ne için kullanılır?ELIGARD'ın ambalajı, içerisinde etkin maddeyi sulandırmak için kullanılan berrak, renksiz ila açık sarı renkli çözücüyü içeren 1 adet kullanıma hazır şırınganın (Şırınga A) ve beyaz ila kirlibeyaz renkli toz halindeki etkin maddeyi içeren 1 adet kullanıma hazır şırınganın (Şırınga B)bulunduğu 2 adet tabladan oluşmaktadır. ELIGARD'ın etkin maddesi, gonadotropin salgılatıcı hormonlar olarak bilinen bir ilaç gurubuna aittir. Bu ilaçlar, erkek yetişkin hastalarda bazı cinsiyet hormonlarının (testosteron) üretiminiazaltmak amacıyla kullanılır. ELIGARD, Hormonal müdahaleye uygun ilerlemiş prostat kanseri tedavisinde, Hormonal müdahaleye uygun yüksek riskli prostata sınırlı veya prostatın olduğu bölgeye yayılmış prostat kanserinin radyoterapi ile birlikte tedavisinde kullanılır. 2. ELIGARD'ı kullanmadan önce dikkat edilmesi gerekenlerELIGARD'ı aşağıdaki durumlarda KULLANMAYINIZ:Eğer: Kadın veya çocuk iseniz Leuprorelin asetata, ELIGARD'ın içeriğinde bulunan yardımcı maddelerden herhangi birine(bkz. Bölüm 6) veya doğal olarak vücutta üretilen cinsiyet hormonu salgılatıcı hormona benzeraktivitedeki ürünlere karşı aşırı duyarlılığınız ya da alerjiniz varsa Testisleriniz ameliyatla alınmış ise (Bunun nedeni, böyle bir durumda ELIGARD'ınkanınızdaki testosteron adı verilen erkek cinsiyet hormonu düzeylerinde ilave bir azalmaya yolaçmamasıdır) Eğer omuriliğe bası veya omurgada tümör ile ilişkili belirtiler konusunda şikayetleriniz varsa,bu durumda ELIGARD, prostat kanseri için kullanılan başka tıbbi ürünlerle birliktekullanılabilir. ELIGARD'ı aşağıdaki durumlarda DİKKATLİ KULLANINIZ:Eğer burada verilenlerden herhangi bir duruma sahipseniz Kalp ritmi problemleri (aritmi) dahil olmak üzere herhangi bir kalp veya damar hastalığı veyabu durumların tedavisine yönelik ilaç kullanıyorsanız. Kalp ritmi problemleri ELIGARDkullanırken artabilir. İdrara çıkmada zorluk yaşıyorsanız, tedavinin ilk haftalarında yakından izlenmeniz gerekir. Omurga kemiklerinizde veya beyninizde bilinen bir tümör varsa tedavinin ilk haftalarındayakından izlenmeniz gerekir. Omurilik basısı veya idrara çıkmada zorluk gelişirse. ELIGARD ve benzer etkili diğer ilaçlarlabağlantılı olarak, omuriliğe bası etkisi ve böbrekler ile idrar kesesi arasındaki tüplerde daralmafelç benzeri belirtilerde artışların olduğu şiddetli olgular rapor edilmiştir. Bu komplikasyonlargelişirse, standart tedaviye başlanmalıdır. ELIGARD aldıktan sonraki iki hafta içerisinde, ani baş ağrısı, kusma, zihinsel durumdadeğişim ve bazen bacaklarda sıvı birikmesi, nefes almada güçlük, halsizlik gibi kalp yetmezliğibelirtileri yaşarsanız, doktorunuzu veya tıbbi ekibi uyarmalısınız. Bunlar, ELIGARD ile benzeretki mekanizması olan DİĞER İLAÇLARDA rapor edilmiş tıpta hipofizer apopleksi adıverilen kafatası içinde hipofiz adı verilen, hormon üretmekle görevli bir bezde kanama ileilişkili nadiren görülen olgulardır. ELIGARD tedavisi, kemik yoğunluğunda azalma yani osteoporoza bağlı kırık riskiniartırabilir. ELIGARD'ın da içinde bulunduğu ilaç grubu olan GnRH analogları (benzerleri) ile tedaviedilen erkeklerde, kan şekeri düzeylerinde yükselme ve şeker hastalığı gelişmesi riskinde artışbildirilmiştir. Kan şekeri (serum glikozu) düzeylerinde yükselme, şeker hastalığı gelişmesineveya şeker hastalığı olan hastalarda kan şekeri kontrolünün kötüleşmesine sebep olabilir. Tedaviniz sırasında, doktorunuz kan şekeri değerinizi ve/veya kan şekeri ile ilgili ölçümlerde kullanılan HbA1c değerinizi periyodik olarak izleyerek, kan şekeri düzeyi artışı veya şekerhastalığı için hali hazırda uygulanan tedavinizle birlikte ELIGARD ile tedavinizi kontroledebilir. ELIGARD'ın içinde bulunduğu ilaç grubu olan GnRH analogları kullanılan erkeklerde, kalpkrizi, kalp hastalığına bağlı ani ölüm ve felç olguları bildirilmiştir. Eldeki veriler bu riskindüşük olduğunu göstermektedir ve prostat kanserli hastalarda tedavi belirlenirken kalp-dolaşımsistemine ait risk faktörleri göz önüne alınmalıdır. Doktorunuz kalp-dolaşım sistemihastalıklarına ait belirti ve bulguları ELIGARD ile tedaviniz devam ettiği sürece takipedecektir. ELIGARD kullanan hastalarda depresyon (iç sıkıntısı, bunaltı ile seyreden bir durum) olgularıbildirilmiştir. ELIGARD kullanıyor ve depresif bir duygudurum içerisine giriyorsanız,doktorunuzu bilgilendiriniz. ELIGARD kullanımı sonrası hastalarda nöbetler rapor edilmiştir. Eğer ELIGARD alıyorsanızve nöbet geçirirseniz doktorunuzu bilgilendiriniz. Tedavi başlangıcında tedaviye bağlı oluşabilecek sorunlar Tedavinin ilk haftası süresince, kandaki erkek cinsiyet hormonu testosteronda genel olarak kısa süreli bir artış olur. Bu durum, hastalıkla ilgili belirtilerde geçici bir kötüleşmeye ve ayrıca buzamana kadar görülmemiş yeni belirtilerin ortaya çıkmasına neden olabilir. Bunlar arasındaözellikle kemiklerde ağrı, idrara çıkmada güçlükler, omurilik basısı veya kanlı idrar yapmak yeralmaktadır. Bu belirtiler genellikle tedaviye devam edilmesi halinde hafifler. Eğer belirtilerhafiflemezse doktorunuza başvurunuz. Eğer ELIGARD size fayda vermiyorsa, Hastaların bir kısmında, düşük serum testosteron düzeylerine duyarlı olmayan tümörler olacaktır. Eğer ELIGARD'ın etkisinin çok zayıf olduğuna dair bir izleniminiz varsa, lütfen doktorunuzadanışınız. Bu uyarılar geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız. ELIGARD'ın yiyecek ve içecek ile kullanılmasıUygulama yöntemi açısından yiyecek ve içeceklerle etkileşimi yoktur. HamilelikELIGARD kadınlarda kullanılmamaktadır, gebelikte kullanılmaz. EmzirmeELIGARD kadınlarda kullanılmamaktadır, emzirme döneminde kullanılmaz. Araç ve makine kullanımıYorgunluk, baş dönmesi ve görme bozuklukları, ELIGARD tedavisinden veya altta yatan hastalıktan kaynaklanan olası yan etkilerdir. Eğer bu yan etkilerden şikayetçiyseniz, araç vemakine kullanırken dikkatli olmalısınız. ELIGARD'ın içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgilerELİGARD'ın içeriğinde bulunan yardımcı maddeler ile ilgili özel bir uyarı gerektirmemektedir. Diğer ilaçlar ile birlikte kullanımıELIGARD, kalp ritmi problemlerinin tedavisinde kullanılan bazı ilaçlar ile etkileşime girebilir (örn. kinidin, prokainamid, amiodaron veya sotalol) veya bazı tür ilaçlar ile birlikte kullanıldığındakalp ritmi problemi riskini arttırabilir (örn. metadon (ağrı kesici ve ilaç bağımlılığıdetoksifikasyonu tedavisinin bir parçası olarak kullanılır), moksifloksasin (bir antibiyotik), ciddiakıl hastalıkları için kullanılan antipsikotikler). Eğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlarda kullandıysanız lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.3. ELIGARD nasıl kullanılır?Uygun kullanım ve doz/uygulama sıklığı için talimatlarELIGARD, her zaman doktorunuzun size tarif ettiği şekilde kullanılmalıdır. Emin olmadığınız durumlarda doktorunuza veya eczacınıza danışınız. Doktorunuz tarafından aksi reçete edilmediği takdirde, tavsiye edilen ELIGARD dozu altı ayda bir kez uygulanan 45 mg'dır. Cilt altına şırınga ile uygulanan çözelti, bir etkin madde deposu oluşturarak, altı ay boyunca devamlı etkin madde olan leuprorelin asetat salımı gerçekleştirir. İlerlemiş prostat kanserinin ELIGARD ile tedavisi uzun dönem tedaviyi gerektirmektedir, hastalık belirtileri görülmediğinde ya da düzelme görüldüğünde bu tedavi kesilmemelidir. İlave testlerELIGARD tedavisine verilen cevap, bazı klinik değerler ve prostata özgü antijenin (PSA) kan düzeylerinin ölçülmesi yoluyla doktorunuz tarafından kontrol edilmelidir. Uygulama yolu ve metoduELIGARD, sadece doktorunuz veya hemşireniz tarafından uygulanacaktır. Bu kişiler, kullanıma hazır çözeltinin hazırlanmasını da sağlayacaklardır (bu kullanma talimatının sonunda yer alansağlık çalışanlarına yönelik bölümde geçen talimatlara uygun olarak). ELIGARD, hazırlandıktan sonra deri altına şırınga ile uygulanır. Atar veya toplardamar içine uygulanmamalıdır. Deri altındaki dokuya şırınga ile verilen diğer etkin maddelerde olduğu gibi,cilt altına uygulanan yer aralıklı olarak değiştirilmelidir. Değişik yaş grupları:Çocuklarda kullanımı:ELIGARD 0-18 yaş arası çocuklarda kullanılmamaktadır. Yaşlılarda kullanımı:İleri yaştaki hastalarda kullanımıyla ilgili özel bir uyarı bulunmamaktadır. Özel kullanım durumları:Böbrek veya karaciğer fonksiyon bozukluğu olan hastalarda klinik araştırma yapılmamıştır. Bu nedenle özel bir uyarı bulunmamaktadır. Böbrek yetmezliği:Özel bir kullanım durumu bulunmamaktadır. Karaciğer yetmezliği:Özel bir kullanım durumu bulunmamaktadır. Eğer ELIGARD 'ın etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.Kullanmanız gerekenden daha fazla ELIGARD kullandıysanızEnjeksiyon genellikle doktorunuz veya uygun eğitimi almış bir sağlık personeli tarafından uygulandığı için doz aşımı beklenmez. Ancak yine de gereğinden fazla miktarda uygulama yapıldıysa, doktorunuz sizi özel olarak muayene edecek ve gerekli ek tedaviyi uygulayacaktır. ELIGARD 'dan kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.ELIGARD'ı kullanmayı unutursanızAltı aylık ELIGARD uygulamanızın unutulmuş olduğuna inanıyorsanız, lütfen doktorunuzla konuşunuz. Unutulan dozları dengelemek için çift doz almayınız.ELIGARD ile tedavi sonlandırıldığında oluşabilecek etkilerGenel kural olarak, ELIGARD ile ilerlemiş prostat kanserinin tedavisi uzun süreli bir tedavi gerektirmektedir. Bu nedenle, belirtilerde bir gelişme olsa bile veya belirtiler tamamen yok olsabile tedavi durdurulmamalıdır. Eğer ELIGARD tedavisi vaktinden önce sonlandırılırsa, hastalık ile ilişkili belirtilerde kötüleşme görülebilir. Doktorunuza danışmadan, tedaviyi vaktinden önce sonlandırmayınız. İlacın kullanımı ile ilgili ilave sorularınızın olması durumunda, doktorunuza veya eczacınıza danışınız. 4. Olası yan etkiler nelerdir?Tüm ilaçlar gibi ELIGARD'ın içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir. ELIGARD tedavisi sırasında gözlenen yan etkiler, genellikle etkin madde leuprorelin asetatın özgün etkisine atfedilebilen, belli hormon konsantrasyonlarında artma ve azalma gibi yanetkilerdir. En yaygın tanımlanan yan etkiler; sıcak basmaları (hastaların yaklaşık %58'i), bulantı,keyifsizlik, yorgunluk ve aynı zamanda enjeksiyon bölgesindeki geçici bölgesel tahrişlerdir. Başlangıçtaki yan etkilerELIGARD tedavisinin ilk haftalarında, hastalığa özgü belirtiler kötüleşebilir, çünkü genellikle ilk olarak kandaki erkek cinsiyet hormonu testosteronda kısa süreli bir artış olur. Bu nedenle,doktorunuz tedavinin başında, tedavi sonrasındaki yan etkileri azaltmak amacıyla uyguntestosteron etkisini engelleyen anti-androjen grubu bir ilaç uygulayabilir (Bkz. 2. ELIGARD'ıkullanmadan önce dikkat edilmesi gerekenler; Tedavi başlangıcında tedaviye bağlı oluşabileceksorunlar).Bölgesel yan etkilerELIGARD enjeksiyonundan sonra tanımlanmış olan bölgesel yan etkiler, benzer cilt altına şırınga ile uygulanan ilaçlar ile ilişkili olan yan etkilerle uyumludur. Cilt altına uygulamadan hemen sonrahafif bir yanma hissi çok yaygındır. Enjeksiyondan sonra batma ve ağrı, enjeksiyon yerindemorarma yaygındır. Enjeksiyon yerinde kızarıklık yaygın olarak bildirilmiştir. Doku sertleşmesive ülserleşme (yara oluşması) seyrektir. Deri altına etken madde uygulamasını takiben görülen söz konusu bölgesel yan etkiler hafiftir ve bunların kısa süreli oldukları tanımlanmıştır. Bu etkiler, enjeksiyonlar arasında yenidenoluşmamaktadır. Aşağıdakilerden biri olursa, ELIGARD'ı kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz: Ani bilinç kaybı, bayılma Enjeksiyon yerinde doku ölümü (nekroz) Anaflaktik/anaflaktoid reaksiyonlar (döküntü, kaşıntı, nefes almada güçlük, ağız, yüz,dudaklar veya dilde şişme) Bunların hepsi çok ciddi yan etkilerdir. Eğer bunlardan biri sizde mevcut ise, sizin ELIGARD'a karşı ciddi alerjiniz var demektir. Acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerekolabilir. Aşağıdakilerden herhangi birini fark ederseniz, hemen doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz: Anormal istemsiz hareketler Deri döküntüsü (deride kabarcıklar) Bunların hepsi ciddi yan etkilerdir. Acil tıbbi müdahale gerekebilir. Yan etkiler aşağıdaki kategorilerde gösterildiği şekilde sıralanmıştır: Çok yaygın: 10 hastanın en az birinde görülebilir. Yaygın: 10 hastanın birinden az fakat 100 hastanın en az birinde görülebilir. Yaygın olmayan: 100 hastanın birinden az fakat 1000 hastanın en az birinde görülebilir. Seyrek: 1000 hastanın birinden az fakat 10.000 hastanın en az birinde görülebilir. Çok seyrek: 10.000 hastanın birinden az görülebilir. Bilinmiyor: Eldeki verilerden hareketle tahmin edilemiyor. Çok yaygın: Sıcak basmaları Deri ve ağız içi, burun içi gibi parlak, nemli yüzeylerde ani kanamalar, deride kızarıklık Yorgunluk, enjeksiyonla ilişkili yan etkiler (Bkz. Yukarıda belirtilen bölgesel yan etkiler)Yaygın: Nazofarenjit (soğuk algınlığı belirtileri,) Bulantı, kırıklık, ishal, mide-bağırsakta inflamasyon (gastroenterit /kolit) Kaşıntı, gece terlemesi Eklemlerde kaslarda ağrı, kol ve bacaklarda ağrı İdrar yapmak için düzensiz olarak tuvalete gitmek (gece ve gündüz), idrar yapmaya başlarkenzorluk, ağrılı idrar yapma, idrar miktarında azalma Memede hassasiyet, memelerde şişlik, erbezlerinde (testislerde) küçülme, erbezlerinde(testislerde) ağrı, kısırlık, ereksiyon bozukluğu, penis boyutunda küçülme Titremeler (yüksek ateşle birlikte aşırı titreme nöbetleri), halsizlik Kanama süresinin uzaması, kan değerlerinde değişimler, kırmızı kan hücresi sayısında,hematokrit ve hemoglobinde azalma Bitkinlik, enjeksiyon yerinde ağrı, enjeksiyon yerinde morarma, enjeksiyon yerinde iğnebatmaları, zayıflık Yaygın olmayan: İdrar yolu enfeksiyonu, bölgesel deri enfeksiyonu Şeker hastalığında kötüleşme Anormal rüyalar, depresyon (ruhsal çöküntü), cinsel istekte azalma Sersemlik hali, baş ağrısı, deri hassasiyetinde değişiklik, uykusuzluk, tat alma duyusundabozulma, koku alma duyusunda bozulma, vertigo Hipertansiyon (yüksek kan basıncı), hipotansiyon (düşük kan basıncı) Nefes darlığı Kabızlık, ağız kuruluğu, dispepsi (midede şişkinlik, mide ağrısı, geğirme, bulantı, kusma,midede yanma hissi gibi belirtilerle birlikte hazım bozukluğu), kusma Islaklık, terlemede artış Sırt ağrısı, kaslarda kasılmalar (kramplar) İdrarda kan İdrar kesesinde kasılmalar, idrar yapmak için normalden daha sık tuvalete gitmek, idraryapamamak Erkek meme dokusunun büyümesi, iktidarsızlık, testiküler yetmezlik Enjeksiyon yerinde kaşıntı, uyuşukluk hissi, ağrı, ateş Kilo artışı Rinore (burun akıntısı) Denge kaybı, baş dönmesi Uzun süre kullanım sonrası kas erimesi, kas dokusu kaybı Seyrek: Ani bilinç kaybı, bayılma Anormal istemsiz hareketler Deri döküntüsü (deridekabarcıklar) Gazı olma, geğirme Saç dökülmesi Meme ağrısı Enjeksiyon yerinde doku yaralaşması (ülserasyonu) Ani baş ağrısı, kusma, zihinsel durumda değişim ve bazen bacaklarda sıvı birikmesi, nefesalmada güçlük, halsizlik gibi kalp yetmezliği belirtileri ile seyreden kafatası içinde hipofiz adıverilen, hormon üretmekle görevli bir bezde kanama Trombositopeni (trombosit - kan pulcuğu sayısında azalma) Lökopeni (Akyuvar sayısında azalma) Çok Seyrek: Enjeksiyon yerinde doku ölümü (nekroz) Bilinmiyor: EKG'de değişiklik (QTuzaması) Akciğer iltihaplanması,akciğer hastalığı Diğer yan etkilerELIGARD'ın etkin maddesi leuprorelin asetatla ilgili olarak literatürde tanımlanan diğer yan etkiler ödem (dokuda sıvı birikmesi, ellerde ve ayaklarda şişme olarak gözlenir), pulmonerembolizm (nefessiz kalma, nefes almada güçlük ve göğüste ağrı gibi belirtilerle sonuçlanır),çarpıntılar (kalp atışlarını fark etmek), kas ağrısı, kaslarda güçsüzlük, deri hassasiyetindedeğişiklik, ürperme, periferik vertigo (denge bozukluğundan kaynaklanan baş dönmesi) döküntü,unutkanlık ve görüşün bozulmasıdır. Kan şekerinin uygun düzeylerde tutulmaması gibideğişiklikler bildirilmiştir. ELIGARD ile uzun süreli tedaviden sonra kemik dokusunda azalma (osteoporoz) belirtilerinin artması beklenebilir. Osteoporoza bağlı olarak azalan kemik yoğunluğu sebebiyle kırık riskiartmaktadır. ELIGARD ile aynı sınıfa ait ürünlerin kullanımından sonra nadiren, nefes alma güçlüğü ve baş dönmesi gibi ciddi alerjik reaksiyonlar rapor edilmiştir. ELIGARD ile aynı sınıfa ait ürünlerin kullanımından sonra nöbetler rapor edilmiştir Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız doktorunuzu veya eczacınızı bilgilendiriniz.Yan etkilerin raporlanmasıKullanma Talimatında yer alan veya almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yan etkileriwww.titck.gov.tr sitesinde yer alan İlaç Yan Etki Bildirimi ikonuna tıklayarak ya da 0 800 31400 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi (TÜFAM)'nebildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacın güvenliliğihakkında daha fazla bilgi edinilmesine katkı sağlamış olacaksınız. 5. ELIGARD'ın saklanmasıELIGARD 'ı çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.Son kullanma tarihiyle uyumlu olarak kullanınız.Ambalajdaki son kullanma tarihinden sonra ELIGARD 'ı kullanmayınız.Saklama talimatları:Buzdolabında (2°C-8°C arasındaki sıcaklıklarda) ve orijinal ambalajında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. Bu ürün enjeksiyondan önce oda sıcaklığında olmalıdır. Kullanılmadan yaklaşık 30 dakika önce buzdolabından çıkarılmalıdır. Buzdolabından çıkarıldıktan sonra bu ürün, orijinal ambalajında odasıcaklığında (25°C'nin altında) dört haftaya kadar saklanabilir. Tablayı açar açmaz ürünü derhal hazırlayınız. Ürün sulandırıldıktan (hazırlandıktan) sonra hiç bekletilmeden kullanılmalıdır. Sadece tek kullanımlıktır. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz. Ruhsat sahibi:Recordati İlaç San. ve Tic. A Ş.Ç.O.S.B. Karaağaç Mah. Atatürk Cad. No:36 Kapaklı / TEKİRDAĞ Tel: 0 282 999 16 00Faks: 0 282 999 16 61 Üretim yeri:Tolmar Inc.701 Centre Avenue, Ft. Collins, CO 8052, ABD Bu kullanma talimatı tarihinde onaylanmıştır.AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİRKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Kullanıma hazırlama: Ürünü, kullanımından yaklaşık 30 dakika önce buzdolabından çıkararak oda sıcaklığına gelmesini bekleyiniz.Lütfen ilk olarak hastayı enjeksiyon için hazırlayınız, ardından aşağıdaki talimatları uygulayarak ürünün hazırlığını yapınız.Eğer ürün uygun teknik kullanılarak hazırlanmadıysa, ürünün hatalı sulandırılması sonucunda doğacak klinik etkinlik eksikliğinden ötürü ürün hastaya uygulanmamalıdır.Diğer benzer ajanlar gibi, karıştırma ve uygulama sürecince eldiven kullanımı önerilmektedir. Adım 1:Her iki tablayı açın (folyoyu, küçük bir baloncuk ile belirginleştirilmiş köşeden yırtın) ve içindekileri (Şırınga A (Şekil 1.1) ve Şırınga B'yi (Şekil 1.2) içeren iki tabla) temiz bir alana boşaltınNem çekici torbaları atın.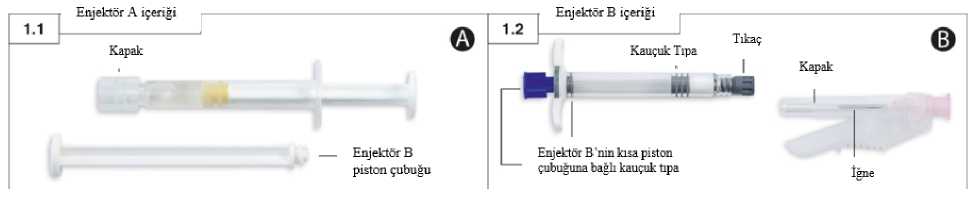
Adım 2:çekin. İki tıpayı çevirerek açmaya çalışmayınİki tıpa da takılı iken ürünü karıştırmayaçalışmayın!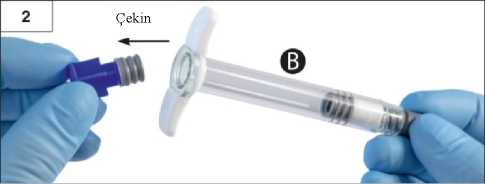
Adım 3:Şırınga B beyaz piston çubuğunu, Şırınga B'de kalan gri tıpaya nazikçe sıkın (Şekil 3).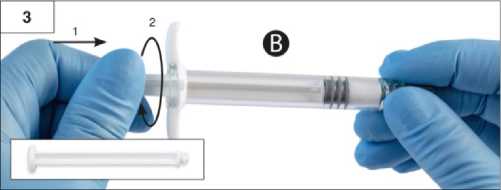 Adım 4:Şırınga B'de gri renkli kauçuk kapağı çıkarın ve enjektörü bırakın (Şekil 4).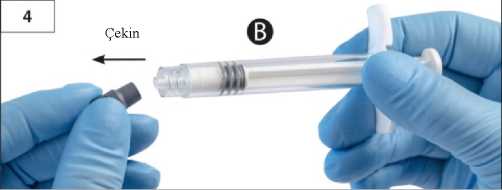 Adım 5:Sıvı sızmaması için Şırınga A'yı dikey konumda tutun ve Şırınga A'dan şeffaf kapağı çevirerek çıkarın (Şekil 5).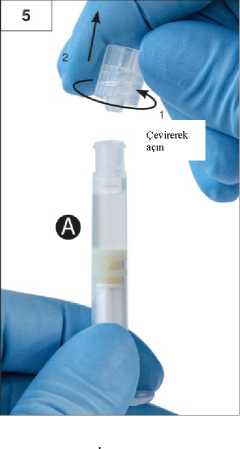 Adım6:Aşırı sıkmayın.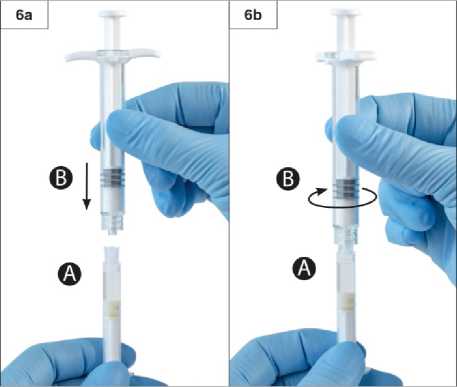
Adım7:Bağlanan üniteyi ters çevirin ve Şırınga A'nın sıvı içeriğini tozu (leuprorelin asetat) içeren Şırınga B'ye enjekte ederken Şırınga B altta olacak şekilde enjektörleri dikey şekilde tutmayadevam edin (Şekil 7).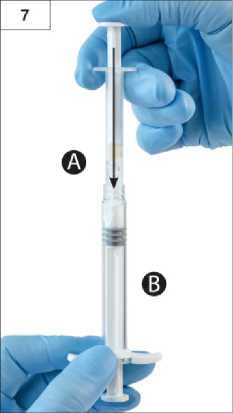
Adım 8:Tamamen karıştığında viskoz çözelti renksiz ila beyaz veya açık (beyaz ila açık sarının tonları dahil) renk alacaktır.Önemli: Ürün zaman geçtikçe daha viskoz hale geldiğinden, karıştırdıktan sonra hemen bir sonraki adıma geçiniz. Karıştırılmış ürünü soğutucuya koymayın.Lütfen dikkat: Ürün, anlatıldığı şekilde karıştırılmalıdır; çalkalama işlemi ürünün yeterince karışmasını SAĞLAMAZ. Adım 9:Şırınga B altta olacak şekilde enjektörleri dikey konumda tutun. Enjektörler güvenli şekilde birleşmiş kalmalıdır. Şırınga A pistonuna bastırarak ve Şırınga B pistonunu hafifçeçekerek, karıştırılmış ürünün tamamını Şırınga B'ye (geniş enjektör) çekin (Şekil 9).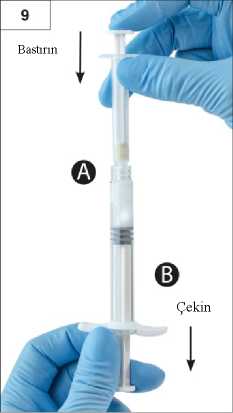
Adım 10:Şırınga A pistonunu bastırmaya devam ederken Şırınga A'yı çevirerek çıkarın (Şekil 10). Ürünün sızmadığından emin olun; aksi halde iğne, takıldığında tam olarak sabitlenmez.Lütfen dikkat: Formülasyonda bir tane büyük veya birkaç tane küçük hava kabarcığı kalabilir, bu kabul edilebilir bir durumdur. Ürün kaybolacağından lütfen bu aşamada Şırınga B'deki havakabarcıklarını püskürtmeyin!Adım 11: Şırınga B'yi dik konumda tutun ve ürün kaybını engellemek için beyaz pistonu arkadandestekleyin. Arka kağıt etiketini soyarak güvenlik iğnesi paketini açın ve güvenlik iğnesini çıkartın.Hareketli güvenlik kalkanından çıkarmayınız. Enjektörü tutarak güvenlik iğnesini Şırınga B'ye sabitleyin ve iğne sabitlenene kadar saatyönünde yaklaşık üç çeyrek tur hafifçe döndürün. (Şekil 11) İğne başlığında meydana gelecek herhangi bir çatlak enjeksiyon esnasında sızıntıya neden olabileceğinden dolayı iğne gereğinden fazla sıkmayın. İğne başlığının çatlaması, hasar görmesi veya herhangi bir sızıntı olması halinde ürün kullanılmamalıdır. Hasarlı iğne verisi ile değiştirilmemeli ve ürün enjekte edilmemelidir. Tümürün güvenli bir şekilde imha edilmelidir. İğne başlığının hasar görmesi halinde yeni bir ikame ürün kullanılmalıdır. Adım 12:Uygulama öncesinde, güvenlik kalkanını iğneden çıkartın ve koruyucu iğne kapağını çekin (Şekil 12).Önemli: Uygulamadan önce güvenlik iğnesi mekanizmasını çalıştırmayın.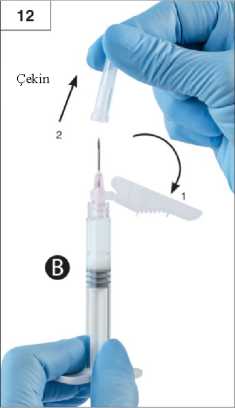
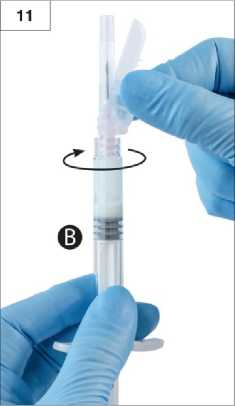
Adım 13:Uygulama öncesinde, Şırınga B'deki büyük hava kabarcıklarını püskürtün. Güvenlik kalkanını iğneden uzaktayken ürünü subkutan yolla uygulayın. Şırınga B'deki ürünün tamamınınenjekte edildiğinden emin olun.Adım 14:1. Düz zemin üzerinde kapatmaİğneyi kapatmak ve güvenlik kalkanını kilitlemek için güvenlik kalkanını, düz tarafı aşağı gelecek şekilde düz bir yüzeye bastırın (Şekil 14.1a ve b). Kilitlendiğini, elinizle ve çıkan "klik" sesi ile kontrol edin. Kilitli konum iğne ucunu tamamen kapatacaktır (Şekil 14.1b). 14,1a 14.1b2. Parmağınızla kapatmaParmağınızı güvenlik kalkanının üzerine koyun (Şekil 14.2a), iğne ucunu kapatın ve güvenlik kalkanını kilitleyin. Kilitlendiğini, elinizle ve çıkan "klik" sesi ile kontrol edin. Kilitli konum iğne ucunu tamamen kapatacaktır (Şekil 14.2b). 14.2a
Adım 15: Güvenlik kalkanı kilitlendiğinde, derhal iğneyi ve enjektörü, onaylı bir tıbbi atık kutusuna atın. |
İlaç BilgileriEligard 45 Mg Enjeksiyonluk Çözelti İçin S.c. Toz İçeren Şırınga ve Çözücü İçeren ŞırıngaEtken Maddesi: Leuprorelin Asetat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2024 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.