Kan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Kan Koagülasyon (pıhtılaşma) Faktörleri » İnsan Faktör IX Konsantresi
KULLANMA TALİMATI
AIMAFIX 500 IU/10 mL IV infüzyon için liyofilize toz içeren flakon Steril, apirojen
Damar içine (intravenöz) uygulanır.
Etkin madde:Yardımcı madde(ler):
Sodyum klorür, sodyum sitrat, glisin, heparin sodyum, antitrombin III enjeksiyonluk su
Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
Bu kullanma talimatım saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz.
Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız,
Bu ilaç kişisel olarak sizin için reçete edilmiştir, başkalarına vermeyiniz
Bu ilacın kullanımı sırasında doktora veya hastaneye gittiğinizde, doktorunuza bu ilacı kullandığınızı söyleyiniz.
Bu talimatta yazılanlara aynen uyunuz. ilaç hakkında size önerilen dozun dışındayüksekveya düşük dozkullanmayınız
_
Bu Kullanma Talimatında:
1. AIMAFIX nedir ve ne için kullanılır?
2. AİMAF1X kullanmadan önce dikkat edilmesi gerekenler
1.AIMAFIX nasıl kullanılır?
4.Olası yan etkiler nelerdir?
5. AIMAFIX'in saklanması
Başlıkları yer almaktadır.
1. AIMAFIX nedir ve ne için kullanılır?
AIMAFIX, kanamayı önleyici/durdurucu etkisi (antihemorajik) sınıfa dahil insan kanından elde edilmiş Faktör IX içeren bir üründür.
AIMAFIX, toz içeren tip I elastomer kapaklı hidrolitik sınıf berrak cam flakon; 10 mL çözücü içeren 1 adet flakon, enjeksiyon için şırınga, kelebek iğnesi ve üç yollu rekonstitüsyon işlem cihazını içermektedir.
AIMAFIX, Hemofili B (Konjenital Faktör IX yetmezliği), Edinilmiş Faktör IX yetmezliğinde, kanamanın tedavisi veya korunmasında (profılaksisinde) kullanılır.
2. AIMAFIX'i kullanmadan önce dikkat edilmesi gerekenler
AIMAFIX, insan kanının sıvı olan kısmından (plazmasından) elde edilir. Bu nedenle pek çok insanın kanı toplanmakta ve bu kanların plazmasından yararlanılmaktadır. İlaçlar insan kanı ya da plazmasından üretildiğinde, hastalara geçebilecek hastalık nedenlerini önlemek için bir dizi önlemler alınır. Bunlar, hastalık taşıma riski olan kan vericilerini saptamak ve dışarıda
bırakıldıklarından emin olmak için, kan ve plazma vericilerinin dikkatli bir şekilde seçimini ve her bir kan bağışının ve plazma havuzlarının, virüs/infeksiyon belirtileri açısından test edilmesini içerir. Bu ürünlerin üreticileri ayrıca, kanın ve plazmanın işlenmesi sürecine virüsleri arındıracak ya da etkisiz hale getirecek basamakları da dahil ederler.
Virüs güvenliği
İnsan kanı veya plazmasından hazırlanan tıbbi ürünlerin kullanımından kaynaklanan enfeksiyonların önlenmesi için standart önlemler; donörlerin seçimi, bireysel bağışçıların ve plazma havuzlarının taranması için spesifik enfeksiyon belirteçlerinin kullanılması ve virüslerin inaktivasyonu/uzaklaştırılması için etkili üretim aşamalarını içermektedir.
Creutzfeldt-Jacob hastalığı'nın teorik olarak geçiş riski en aza indirilmiştir. Alınan bu önlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir. Bu ürün insan kanından üretildiği için, örneğin virüsler ve teorik olarak Creutzfeldt-Jacob hastalığının (CJO) etkeni gibi enfeksiyon etkenlerini bulaştırma riski taşıyabilir.
Plazma kaynaklı Faktör IX alan tüm hastalar için uygun aşılama önerilir (Hepatit A ve B).
Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolitik anemi gibi).
Tüm bu önlemlere rağmen insan plazmasından elde edilen ürünler enfeksiyon bulaştırma riski taşıyabilmektedir. Bu nedenle ileride oluşabilecek bir hastalıkta kullanılmış ürün ile aradaki bağlantıyı kurabilmek için, kullandığınız ürünün adı ve seri numarasını kaydederek bu kayıtları saklayınız.
AIMAFIX'i aşağıdaki durumlarda KULLANMAYINIZ
Eğer;
AIMAFIX'e veya içinde bulunan etkin maddeye veya yardımcı maddelere karşı herhangi bir aşırı duyarlılık durumu varsa
Bu ilacı kullanmayınız ve bu durumunuzu doktorunuza mutlaka bildiriniz.
AIMAFIX'i aşağıdaki durumlarda DİKKATLİ KULLANINIZ
Eğer;
Herhangi bir damar içi (intravenöz) protein ürününe karşı aleıjik türde aşırı duyarlılığınız varsa
Daha Önce alerjik reaksiyon geçirdiyseniz
Bu uyanlar geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız.
AIMAFIX'in yiyecek ve içecek ile kullanılması
AIMAFIX uygulanmaları aç veya tok kamına yapılabilir.
Hamilelik
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX enjeksiyonu hamilelik döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınız.
Emzirme
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX, emzirme döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Araç ve makine kullanımı
AIMAFIX'in araç ve makine kullanımına hiçbir etkisi gözlenmemiştir.
AIMAFIX içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgiler
AIMAFIX 1,6 mmol (36,8 mg) sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
AIMAFIX, 50 IU heparin sodyum içermektedir. Alerjik reaksiyonlara ve kanın pıhtılaşma sistemini etkileyebilecek olan kan hücre sayısında düşmelere neden olabilir. Geçmişinde heparinle indüklenmiş alerjik reaksiyonu olan hastaların heparin ihtiva eden ilaçları kullanmaktan kaçınmaları gerekir.
Diğer ilaçlar ile birlikte kullanımı
İnsan plazma koagülasyon Faktör IX konsantratımn diğer ilaçlarla herhangi bir etkileşimi bugüne kadar bilinmemektedir. Ancak AIMAFIX diğer ilaçlarla karıştırılmamalıdır.
Eğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlarda kullandınız ise lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.
3. AIMAFIX nasıl kullanılır?
Uygun kullanım ve doz/uygulama sıklığı için talimatlar:
'Doktorunuz hastalığınıza bağlı olarak ilacınızın dozunu belirleyecek ve size uygulayacaktır.' Uygulama yolu ve metodu:
Damar içine (intravenöz) yavaş olarak enjekte edilir ya da infuzyonla verilir.
Değişik yaş grupları:
Çocuklarda kullanımı:
6 yaşından küçük çocuklarda AIMAFIX kullanımına ilişkin yeterli veri yoktur.
Yaşlılarda kullanımı:
Yaşlı popülasyonda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Özel kullanım durumları:
Böbrek/ Karaciğer yetmezliği:
Böbrek/karaciğer yetmezliği olan hastalarda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Eğer AIMAFLK'in etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.
Kullanmanız gerekenden daha fazla AIMAFIX kullandıysanız:
AİMAFIX'den kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.
AIMAFIX'i kullanmayı unutursanız
Unutulan dozları dengelemek için çift doz almayınız,
AIMAFIX ile tedavi sonlandırıldığındaki oluşabilecek etkiler
Herhangi bir veri bulunmamaktadır.
4. Olası yan etkiler nelerdir?
Tüm ilaçlar gibi, AIMAFIX'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bilinmiyor
Aşın duyarlılık veya alerjik reaksiyonlar, alerjik şok Yaygın ürtiker (kurdeşen)
Kalp atımının hızlanması Kalp krizi Hipotansiyon
Göğüs sıkışması (göğüs ağrısı)
Hırıltılı solunum Böbrekte bozukluklar Ani damar tıkanıklıkları Soğuk algınlığı nöbeti Enfeksiyon hastalıkları
Yüksek ateş Baş ağrısı Bulantı, kusma Huzursuzluk Halsizlik
İnfıizyon yerinde yanma ve kaşıntı (inftizyon yerinde ağrı)
Karıncalanma
Ödem
Ciltte kızarıklık
Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız, doktorunuzu veya eczacınızı bilgilendiriniz.
5. AIMAFIX'in saklanması
AIMAFIX'i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.
2-8 °C' de (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünü çözüp tekrar kullanmayınız.
Son kullanma tarihiyle uyumlu olarak kullanınız
Ambalajın üzerinde belirtilen son kullanma tarihinden sonra AIMAFlX'i kullanmayınız
.
Eğer ürün ve/veya ambalajında bozukluk fark ederseniz AIMAFIX'i kullanmayınız.
Çevreyi korumak amacıyla kullanmadığınız AIMAFIX'i şehir suyuna veya çöpe atmayınız. Bu konuda eczanıza danışınız.
Ruhsat sahibi:
Onko İlaç San. ve Tic. A.Ş.
Koşuyolu Cad. No:34,
34718, Kadıköy / İstanbul Tel: (0216) 544 90 00 Faks: (0216) 545 59 92
Üretim yeri:
Kedrion S.p.A., Bolognana, Gallicano, 55027, Lucca, İtalya Tel:+39 0583 1969962
Bu kullanma talimatıtarihinde onaylanmıştır.
Tedaviye hemofili tedavisinde deneyimli bir doktorun gözetiminde başlanmalıdır.
Yerine koyma tedavisinin dozu ve süresi hemostatik fonksiyondaki bozukluğun derecesine, kanamanın yerine, önemine ve klinik durumuna bağlıdır. Uygulanan Faktör IX ünitelerinin sayısı Faktör IX ürünleri için güncel Dünya Sağlık Örgütü standardına ilişkin uluslararası ünite (IU) olarak gösterilir. Plazmadaki Faktör IX aktivitesi ya bir yüzde (normal insan plazması ile bağlantılı) ya da uluslararası üniteler(plazmadaki Faktör IX için uluslararası bir standart ilişkin ) olarak gösterilir.
Bir ünite (IU) Faktör IX aktivitesi 1 mL normal insan plazmasında bulunan Faktör IX miktarına eşdeğerdir.
Gerekli Faktör IX dozu, 1 IU/kg Faktör IX'un plazma Faktör IX aktivitesini %0.8 yükselttiği şeklindeki ampirik bulgu esas alınarak hesaplanır.
Gerekli doz aşağıdaki formül kullanılarak hesaplanır.
Gerekli Ünite = Vücut ağırlığı (kg) x İstenen Faktör IX artışı (%) x (karşılıklı gözlenen geri kazanım)
Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre izlenmelidir. Faktör IX ürünleri seyrek olarak günde bir kez uygulamadan daha fazla uygulama gerektirebilir.
Aşağıdaki kanama şekillerinde Faktör IX aktivitesi ilgili dönem süresince belirtilen plazma aktivite seviyelerinin (normalin yüzdesi olarak) altına düşmemelidir. Aşağıdaki tablo kanama episodlan ve müdahalelerde doz için kılavuz olarak kullanılabilir.
Kanama Derecesi/Cerrahi Prosedür Türü |
Gerekli plazma Faktör IX seviyesi (%) |
Dozların Sıklığı (saat)/ Tedavinin Süresi (gün) |
Kanama |
Erken hemartrozis,
Kas kanaması ya da oral kanama
|
20-40
|
Her 24 saatte bir tekrarlanır, ağrı ile oluşan kanama çözülünceye ya da iyileşme sağlanıncaya kadar en az 1 gün
|
Daha büyük hemartrozis Kas kanaması ya da hematom
|
30-60
|
Infüzyon 3-4 gün ya da daha fazla süreyle, ağrı ve akut yetersizlik çözülünceye kadar her 24 saatte tekrarlanmalı
|
Hayatı tehdit eden kanamalar
|
60-100
|
Infüzyon her 8-24 saatte bir tehlike geçinceye kadar tekrarlanmalıdır.
|
Ameliyat |
Minör
Diş çekimi dahil
|
30-60
|
Her 24 saatte bir, iyileşme gerçekleşinceye kadar en az 1 gün süresince.
|
Majör
|
80-100
(pre ve post operatif)
|
İnfiizyon, yeterli yara iyileşmesi oluncaya kadar her 8-24 saatte bir tekrarlanmalıdır, daha sonra faktör IX aktivitesini % 30 -% 60 (IU/dL) arasında sürdürmek için en az 7 gün süresince tedaviye devam edilir.
|
Tedavi süresince, yeterli Faktör IX seviyelerinin belirlenmesi, uygulanacak dozun ve tekrarlanan inftizyonların sıklığına yol göstermek için Önerilir. Özellikle büyük ameliyat durumlarında, koagülasyon analizi (plazma Faktör IX aktivitesi) yoluyla yerine koyma tedavisinin yeterli takibi gereklidir. Her hastanın bireysel olarak farklı
in vivo
geri kazanım ve farklı yarı ömür gösterdiği Faktör IX'a cevabı farklıdır.
Şiddetli Hemofili B hastalarında kanamaya karşı uzun dönem profılaksi için, alışılmış dozlar
3-4 günlük aralıklarla vücut ağırlığının kg başına 20-40 IU Faktör IX'dur. Bazı vakalarda, Özellikle genç hastalarda, daha kısa doz aralıkları ya da daha yüksek dozlar gerekebilir.
Hastalar Faktör IX inhibitörlerinin gelişimi açısından takip edilmelidir. Eğer beklenen Faktör IX aktivitesi plazma seviyelerine ulaşılamazsa, ya da kanama uygun bir doz ile kontrol edilemezse, Faktör IX inhibitörü olup olmadığı bir tahlil yapılarak belirlenmelidir. Yüksek seviyelerde inhibitörlü hastalarda Faktör IX tedavisi etkili olmayabilir ve diğer terapötik seçenekler dikkate alınmalıdır. Bu gibi hastaların tedavisi hemofili hastaların tedavisi konusunda uzman kişiler tarafından yapılmalıdır.
Uygulama şekli:
Flakon içeriğindeki toz haldeki etken madde aşağıda anlatıldığı şekilde çözündürülür.
Ürün, intravenöz yoldan enjeksiyon veya yavaş infuzyon şeklinde uygulanır.
Günde 100 IU/kg'dan fazla dozda uygulanmaması tavsiye edilir.
Uygulamanın hızı her bir hasta için değerlendirilmelidir.
Tozun çözücü ile rekonstitüe edilmesi.
Tozun çözücü ile rekonstitüe edilmesi
1. Toz halde etken madde içeren flakon ve çözücüyü oda sıcaklığına getiriniz;
2. Toz etken madde içeren flakon ve çözücü flakonun kabını çıkarınız;
3. İki flakon tıpasının yüzeyini alkol ile temizleyiniz;
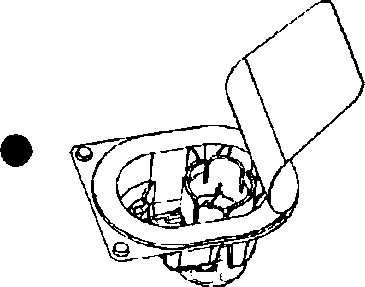
4. Başlığı sıyırarak aparatın ambalajını açın; iç kısma dokunmamaya dikkat ediniz (Şekil A);
5. Aparatı ambalajından çıkarmayınız;
6. Aparat kutusunu baş aşağı çevirin ve çözücü flakon tıpasına doğru plastik sivri ucu yerleştiriniz (Şekil B);
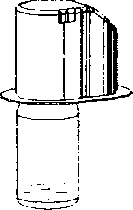
7. Aparatı serbest bırakmak için aparat kutusunun kenarını tutunuz ve çekiniz (Şekil C);
8. Aparatı çözücü flakonuna bağlı bırakın; sistemi ters çevirin böylece çözücü flakonu aparatın üstünde olur;
9. Toz flakon tıpasına doğru diğer sivri uçlu plastiği yerleştirin; toz flakondaki vakum, çözücüyü toz flakonun içine çekecektir (Şekil D);
10. Çözünme tamamlanıncaya kadar yavaşça çalkalayınız (Şekil E); ürünün tamamen çözündüğünden emin olun, diğer türlü etkin madde aparatın filtresinden geçmeyecektir.
Şekil B
Şekil C
Şekil E
ra
Şekil D
Şekil A
Çözücü sıcak su banyosu içinde ısıtılarak, flakonu sulandırdıktan sonra 37 C'nin üstünde olmamak kaydıyla ısıtmaya devam ederek liyofılize maddenin daha çabuk çözülmesi sağlanabilir.
Eğer toz tamamen çözülmezse filtrasyon sırasında aktivite kaybı olur. Flakonun iç yüzeylerine çözücünün yavaşça akması sağlanarak köpük oluşumu önlenir.
Sulandırma süresi 3 dakikadan daha kısadır.
Çözeltinin uygulanması
Çözelti berrak veya hafif opelesan.
Çözeltide katı parçacık olup olmadığını veya uygulamadan önce renginin değişip değişmediğini inceleyin.Bulanık veya tortu olan çözeltileri kullanmayınız.
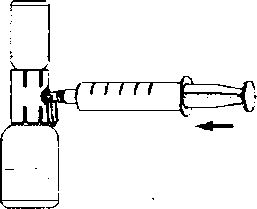
1. Rekonstitüe çözeltiyi içeren toz flakona doğru aparat kapağını çekin ve onu kaplayan kabı uzaklaştırınız (Şekil F);
2. Şırıngayı hava ile doldurun, pistonu geri çekin, aparata tutturun ve havayı rekonstitüe çözeltiyi içeren toz flakonun içine enjekte ediniz (Şekil G);
3. Pistonu bırakın, sistemi ters çevirin böylece toz flakonu aparatın üstündedir ve yavaşça piston geri çekilerek konsantre şırınganın içine çekilir (Şekil H);
4. Kapağı yavaşça orijinal durumuna çevirin ve şırıngayı çıkarınız.
5. Şırıngaya kelebek iğnesini yerleştiriniz ve intravenöz olarak infüze veya yavaşça enjekte ediniz.
Şekil H
Şekil G
Şekil F
n;
Günde 100 IU/kg'dan fazla dozda uygulanmaması tavsiye edilir. İnfüzyon hızı her bir hasta için değerlendirilmelidir.
Mümkün olan tüm durumlarda, uygulanan AIMAFIX için isim ve seri numarasının kaydedilmesi önerilir.
9/9
'i
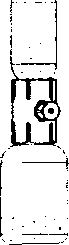


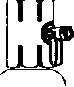
 n;
n;