Adynovate 2000 Iu/5 Ml Iv Enjeksiyonluk Çözelti Hazırlamak İçin Liyofilize Toz ve Çözücü Kullanma TalimatıKULLANMA TALİMATIADYNOVATE 2000 IU/5 mİ IV enjeksiyonluk çözelti hazırlamak için liyofilize toz veçözücüSterilDamar yoluyla alınır. Etkin madde:Rurioktokog alfa pegol [20 kDa PEG-polimeri ile konjuge edilmiş pıhtılaşmafaktör VIII], rekombinant DNA teknolojisi ile Çin Hamster Overi (CHO) hücreleri kullanılaraküretilmiştir. Yardımcı maddeler:Mannitol, trehaloz dihidrat, histidin, glutatyon, sodyum klorür,kalsiyum klorür dihidrat, tris (hidroksimetil) aminometan, polisorbat 80, enjeksiyonluk su.¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Meydana gelen herhangi bir yan etkiyi raporlayarak yardımcı olabilirsiniz. Yanetkilerin nasıl raporlanacağını öğrenmek için 4. bölümün sonuna bakabilirsiniz. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir. Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz. Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız. Bu ilaç kişisel olarak size reçete edilmiştir, başkalarına vermeyiniz. Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde bu ilacı kullandığınızıdoktorunuza söyleyiniz. Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışındayüksek veya düşük doz kullanmayınız.Bu Kullanma Talimatında:1. ADYNOVATE nedir ve ne için kullanıhr?2. ADYNOVATE'i kullanmadan önce dikkat edilmesi gerekenler3. AD YNO VATE nasıl kullanılır?4. Olası yan etkiler nelerdir?5.AD YNO VATE'in saklanmasıBaşlıkları yer almaktadır.
1. ADYNOVATE nedir ve ne için kullanılır?ADYNOVATE, enjeksiyonluk çözelti için bir toz ve çözücü olarak sağlanır (enjeksiyonluk çözelti için toz). Toz, beyaz-kirli beyaz arası renkte dağılan bir tozdur. Çözücü berrak, renksizbir çözeltidir. Sulandırıldıktan sonra, çözelti berrak, renksiz ve yabancı parçacıklardanarındırılmıştır. Her paket kapalı bir blisterde kullanıma hazır bir BAXJECT III sistemi ve üzerine yerleştirilmiş önceden birleştirilmiş toz flakon, sulandırma için çözücü flakon ve uygulama seti kapsamındakelebek iğneli infüzyon seti ve tek kullanımlık enj ektör içerir. Her bir toz flakon, nominal olarak2000 lU rurioktokog alfa pegol içerir. ADYNOVATE, etkin madde rurioktokog alfa pegol (rekombinant DNA teknolojisi ile üretilen pegile insan pıhtılaşma faktörü VIII)'dir. İnsan pıhtılaşma faktörü VIII, etki süresini uzatmakiçin değiştirilmiştir. Faktör VIII, kanın pıhtılaşması ve kanamayı durdurması için gereklidir.Hemofili A hastalarında (doğuştan faktör VIII eksikliği), faktör VIII eksiktir veya düzgünçalışmıyordur. ADYNOVATE, Hemofili A'ya (faktör VIII eksikliğinden kaynaklanan kalıtsal bir kanama bozukluğu) sahip çocuklarda ve yetişkinlerde kanamanın tedavisi ve önlenmesinde kullanılır. 2. ADYNOVATE'i kullanmadan önce dikkat edilmesi gerekenlerADYNOVATE'i aşağıdaki durumlarda KULLANMAYINIZEğer; - Rurioktokog alfa pegol, oktokog alfa veya bu ilacın diğer yardımcı maddelerindenherhangi birine alerjiniz varsa, - Fare veya hamster proteinlerine alerjiniz varsa. ADYNOVATE'i kullanmayınız. Alerjiniz olup olmadığından emin değilseniz, doktorunuza danışınız. ADYNOVATE'i aşağıdaki durumlarda DİKKATLİ KULLANINIZADYNOVATE'i kullanmadan önce doktorunuzla konuşunuz. ADYNOVATE ile anafilaktik reaksiyon (şiddetli, ani bir alerjik reaksiyon) yaşama riskiniz nadirdir. Döküntü, kurdeşen, kabarcıklar, yaygın kaşıntı, dudakların ve dilin şişmesi, solunum güçlüğü, hırıltı, göğüste sıkışma, genel olarak hastalanma hissi ve baş dönmesi gibi alerjik reaksiyonların erken belirtilerinin farkında olmalısınız. Bunlar anafilaktik şokun erkenbelirtileri olabilir; ek belirtiler arasında aşırı derecede baş dönmesi, bilinç kaybı ve nefes almadaaşırı zorluk olabilir. Bu belirtilerden herhangi biri meydana gelirse, enjeksiyonu derhal durdurunuz ve doktorunuza başvurunuz. Solunum güçlüğü ve (neredeyse) bayılma dahil şiddetli belirtiler hemen acil tedavigerektirir. Kalp hastalığınız varsa, kan pıhtılaşma (koagülasyon) rahatsızlıklarında (komplikasyonlarında) artma riski olduğundan dolayı lütfen doktorunuzu bilgilendirin. Faktör VIII inhibitörleri geliştiren hastalar İnhibitörlerin oluşumu (antikorlar), tüm Faktör VIII ilaçlarıyla tedavi sırasında ortaya çıkabilecek bilinen bir rahatsızlıktır (komplikasyondur). Bu inhibitörler, özellikle yüksekseviyelerde, tedavinin düzgün bir şekilde etki etmesini durdururlar ve siz veya çocuğunuz buinhibitörlerin gelişimi açısından dikkatle izlenirsiniz. Siz veya çocuğunuzun kanamasıADYNOVATE ile kontrol altına alınmıyorsa, derhal doktorunuza bildirin. Sonda (Kateter) ile ilişkili rahatsızlıklar (komplikasyonlar) Santral venöz erişim cihazına (CVAD) ihtiyaç duyuyorsanız, lokal enfeksiyonlar, kanda bakteri varlığı ve sonda (kateter) bölgesinde pıhtılaşma (tromboz) dahil olmak üzere CVAD ile ilgilikomplikasyon riski göz önünde bulundurulmalıdır. Çocuklar ve ergenlerYukarıda listelenen uyarılar ve önlemler aynı zamanda çocuklar ve ergenler için de geçerlidir. Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. Bu uyarılar, geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız. ADYNOVATE'in yiyecek ve içecek ile kullanılmasıADYNOVATE'in yiyecek ve içecek ile kullanılmasıyla ilgili herhangi bir ilişkisi bulunmamaktadır. Hamilelikhacı kullanmadan önce doktorunuza veya eczacınıza danışınız.Hamileyseniz, hamile olabileceğinizi düşünüyorsanız veya bebek sahibi olmayı planlıyorsanız, bu ilacı kullanmadan önce tavsiye için doktorunuza danışınız. Hemofili A kadınlarda oldukçanadir görülür. Bu nedenle hamilelik döneminde ADYNOVATE kullanımı konusunda deneyimbulunmamaktadır. Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınız.Emzirmehacı kullanmadan önce doktorunuza veya eczacınıza danışınız.Emziriyorsanız, bu ilacı kullanmadan önce tavsiye için doktorunuza danışın. Hemofili A kadınlarda oldukça nadir görülür. Bu nedenle emzirme döneminde ADYNOVATE kullanımıkonusunda deneyim bulunmamaktadır. Araç ve makine kullanımıADYNOVATE'in araç ya da makine kullanımı üzerinde herhangi bir etkisi bulunmamaktadır veya göz ardı edilebilir etkiye sahiptir. ADYNOVATE'in içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgilerADYNOVATE her flakonda 12, 42 mg'a kadar sodyum (pişirme/sofra tuzunun ana bileşeni) içerir. Bu bir yetişkin için önerilen maksimum günlük diyet sodyum alımının %0,62'sineeşdeğerdir. Vücut ağırlığınıza ve önerilen ADYNOVATE dozunuza bağlı olarak birden fazlaflakon alabilirsiniz. Düşük tuzlu bir diyet uyguluyorsanız bu dikkate alınmalıdır. Diğer ilaçlar ile birlikte kullanımıEğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlardaBelgeT>ekuUmndınxz is& lüif&n^kıorunuzaveyaeczıacmızai^un'tarvHakkinda-3. ADYNOVATE nasıl kullanılır?Uygun kullanım ve doz/uygulama sıklığı için talimatlar:ADYNOVATE ile tedavi, hemofili A hastalarının tedavisinde deneyimli bir doktor tarafından başlatılacak ve denetlenecektir. Doktorunuz, ADYNOVATE dozunuzu durumunuza ve vücut ağırlığınıza ve kanamanın önlenmesi veya tedavisinde kullanılıp kullanılmadığına bağlı olarak hesaplayacaktır. Uygulamasıklığı, ADYNOVATE'in sizin için ne kadar iyi etkili olduğuna bağlı olacaktır. Genellikle,ADYNOVATE ile yerine koyma tedavisi ömür boyu sürecek bir tedavidir. Bu ilacı daima doktorunuzun size söylediği şekilde kullanınız. Emin değilseniz doktorunuza danışınız. Kanamanın önlenmesiNormal ADYNOVATE dozu, kg vücut ağırlığı başına haftada 2 kez uygulanan 40 ila 50 IU'dur. Kanama tedavisiADYNOVATE'in dozu, vücut ağırlığınıza ve elde edilecek faktör VIII seviyelerine bağlı olarak hesaplanır. Hedef faktör VIII seviyeleri, kanamanın şiddetine ve yerine bağlı olacaktır.ADYNOVATE'in etkisinin yetersiz olduğunu düşünüyorsanız, doktorunuzla konuşunuz.Doktorunuz yeterli faktör VIII seviyesine sahip olduğunuzdan emin olmak için uygunlaboratuvar testlerini gerçekleştirecektir. Bu durum özellikle büyük bir ameliyat geçiriyorsanızönemlidir. Uygulama yolu ve metodu:ADYNOVATE genellikle doktorunuz veya hemşireniz tarafından bir toplardamar içine (intravenöz olarak) enjekte edilir. Siz veya bir başkası da ADYNOVATE'i enjeksiyon olarakuygulayabilir, ancak yalnızca yeterli eğitimi aldıktan sonra yapabilir. Kendi kendine uygulamaiçin ayrıntılı talimatlar bu kullanma talimatının sonunda verilmektedir. Değişik yaş grupları:Çocuklarda kullanımı:ADYNOVATE'in çocuklar için uygulanacak dozu erişkinlerdeki ile aynıdır. ADYNOVATE'in dozu, vücut ağırlığınıza ve elde edilecek faktör VIII seviyelerine bağlı olarak hesaplanır
Yaşlılarda kullanımı:Yaşlı hastalarda özel doz ayarlaması yapmaya gerek yoktur. Özel kullanım durumları:Özel kullanımı yoktur. Eğer ADYNOVATE'in etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.Kullanmanız gerekenden daha fazla ADYNOVATE kullandıysanız:ADYNOVATE'i her zaman aynen doktorunuzun size söylediği gibi kullanınız. Emin değilseniz doktorunuz ile birlikte kontrol etmelisiniz. Tavsiye edilenden daha fazlaADYNOVATE enjekte ederseniz, mümkün olan en kısa sürede doktorunuza söyleyiniz. ADYNOVATE'den kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ilekonuşunuz.ADYNOVATE'i kullanmayı unutursanızUnutulan dozları dengelemek için çift doz almayınız.Bir sonraki enjeksiyona planlandığı gibi devam ediniz ve doktorunuzun önerdiği şekilde devam ediniz. ADYNOVATE ile tedavi sonlandırıldığındaki oluşabilecek etkilerDoktorunuza danışmadan ADYNOVATE'i kullanmayı bırakmayınız. Bu ilacın kullanımı hakkında ilave sorularınız varsa, doktorunuza sorunuz. 4. Olası yan etkiler nelerdir?Tüm ilaçlar gibi ADYNOVATE'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir. Aşağıdakilerden biri olursa, ADYNOVATE'i kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:- Aşırı duyarlılık ya da alerjik reaksiyonlar (dudaklarda ve dilde şişme [anjiyoödem], uygulama bölgesinde yanma ve batma, titreme, sıcak basması, ciltte yaygın döküntü,kurdeşen, kırmızı kabarıklar, yaygın kaşıntı, baş ağrısı, kan basıncında düşme, halsizlik, Belge Do
güçlüğü, hırıltılı solunum yer alabilir) genel olarak hasta hissetme, baş dönmesi ve bilinç kaybı nadiren gözlenmiştir ve bazı olgularda ciddi alerjik reaksiyona (anafilaksiye) kadarilerleyebilir (şok dahil). Solunum güçlüğü ve (neredeyse) bayılma dahil şiddetli belirtiler hemen acil tedavi gerektirir. İlgili aşırı duyarlılık reaksiyonları ile birlikte, fare veya hamster proteinine karşı antikorgelişimi çok nadiren gözlenmiştir. Bunların hepsi çok ciddi yan etkilerdir. Eğer bunlardan biri sizde mevcut ise, sizin ADYNOVATE'e karşı ciddi alerjiniz var demektir. Acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerek olabilir. Faktör VIII ile daha önce tedavi almış (150 günden fazla tedavi) olan hastalar için inhibitör antikorlar (bölüm 2'ye bakınız) yaygın olmayan biçimde (100 hastada 1 hastadan az) oluşabilir.Eğer bu durum gerçekleşirse ilacınız düzgün biçimde etki etmiyor olabilir ve kalıcı kanamayaşayabilirsiniz. Bu durumda derhal doktorunuza başvurmalısınız. Aşağıdakilerden herhangi birini fark ederseniz, hemen doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:Yan etkiler aşağıdaki kategorilerde gösterildiği şekilde sıralanmıştır:
Çok yaygın Yaygın
Yaygın olmayan Seyrek görülebilir. Çok seyrek Bilinmiyor : 10 hastanın en az 1'inde görülebilir. : 10 hastanın birinden az, fakat 100 hastanın birinden fazla görülebilir. : 100 hastanın birinden az, fakat 1000 hastanın birinden fazla görülebilir. : 1000 hastanın birinden az, fakat 10.000 hastanın birinden fazla : 10.000 hastanın birinden az görülebilir. : Eldeki verilerden hareketle tahmin edilemiyor. Çok yaygın: Baş ağrısı Faktör VIII inhibisyonu (vücudun Faktör VIII'e karşı antikor [bağışıklık sisteminiztarafından yabancı maddeleri yok etmek amacıyla üretilen özel madde] üretmesi) -(Faktör VIII ile daha önce tedavi görmemiş hastalar) Yaygın:Bu belge Belge Do  ishal Döküntü Baş dönmesi Kurdeşen Yaygın olmayan: Kızarma, alerjik reaksiyon (aşırı duyarlılık) Faktör VIII inhibisyonu (vücudun Faktör VIII'e karşı antikor [bağışıklık sisteminiztarafından yabancı maddeleri yok etmek amacıyla üretilen özel madde] üretmesi) -(Faktör VIII ile önceden tedavi almış hastalar için [150 günden fazla tedavi]) Bazı beyaz kan hücresi türlerinde artış infüzyon reaksiyonu Gözde kızarıklık Deride istenmeyen ilaç reaksiyonu Bilinmiyor: Potansiyel olarak yaşamı tehdit eden reaksiyonlar (anafilaksi) Çocuklarda ilave yan etkiler:Çocuklarda advers reaksiyonların sıklığı, türü ve şiddetinin yetişkinler ile aynı olması beklenir. Yan etkilerin raporlanmasıKullanma Talimatında yer alan veya yer almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yanetkileri www.titck.gov.tr sitesinde yer alan İlaç Yan Etki Bildirimi ikonuna tıklayarak ya da0 800 314 00 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacıngüvenliliği hakkında daha fazla bilgi edinilmesine katkı sağlamış olacaksınız. Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız doktorunuzu veya eczacınızı bilgilendiriniz.5. ADYNOVATE'in saklanmasıADYNOVATE'i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.ADYNOVATE'i buzdolabında (2°C-8°C'de) saklayınız. Dondurmayınız.Işıktan korumak için ADYNOVATE'i karton ambalajında saklayın. Raf ömrü boyunca toz flakonu, 3 ayı geçmeyen tek bir süre boyunca oda sıcaklığında (30 °C'ye kadar) tutulabilir. Bu durumda, bu ilaç bu 3 aylık sürenin sonunda veya ürün flakonu üzerindeyazılı olan son kullanma tarihinde (hangisinin daha önce olursa) geçerliliğini yitirmektedir.Lütfen dış karton ambalajda oda sıcaklığında 3 aylık saklama süresinin son gününü kaydediniz.Ürün oda sıcaklığında saklandıktan sonra buzdolabına geri konulmaz. Hazırlandıktan sonraçözeltiyi soğutmayınız. Toz tamamen çözündüğünde ürünü 3 saat içinde kullanınız. Ürün sadece tek kullanımlıktır. Kullanılmayan çözeltiyi uygun şekilde atınız. Son kullanma tarihiyle uyumlu olarak kullanınız.Etiket ve karton ambalaj üzerindeki son kullanma tarihinden sonra ADYNOVATE'i kullanmayınız.Son kullanma tarihi o ayın son gününü ifade eder. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilik ve İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz. Ruhsat Sahibi:Üretim yeri:Takeda İlaç Sağlık Sanayi Ticaret Limited Şirketi Levent- Şişli/İstanbul Baxalta Manufacturing Sarl Neuchâtel/ İsviçre Bu kullanma talimatı tarihinde onaylanmıştır AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİİÇİNDİRUygulama ŞekliÇözeltinin hazırlanması için sadece her ADYNOVATE paketinde bulunan çözücü ve sulandırma cihazını kullanınız. Toz, diğer tıbbi ürünler veya çözücüler ile karıştırılmamalı veyadiğer sulandırma cihazları ile birlikte kullanılmamalıdır. ADYNOVATE'in her uygulanışında, ürünün adının ve seri numarasının kaydedilmesi şiddetle tavsiye edilir. Soyularak çıkan etiketler, toz flakonunda bulunur. Sulandırma için talimatlar Etiketlerde ve karton ambalajda belirtilen son kullanma tarihinden sonra kullanmayın. Blisterin üzerindeki kapama tamamen mühürlenmemişse, kullanmayın. Hazırlamadan sonra çözeltiyi soğutmayın. 1. Ürün hala soğutucuda saklanıyorsa, kapalı blisteri (sulandırma sistemi ile öncedenbirleştirilmiş toz ve çözücü şişeleri içeren) buzdolabından alın ve oda sıcaklığına (15oC ile25°C arasında) ulaşmasını sağlayın. 2. Ellerinizi sabun ve ılık su ile iyice yıkayın. 3. Kapağı soyup ADYNOVATE blisterini açın. BAXJECT III sistemini blisterden çıkarın. 4. Toz flakonunu, çözücü flakonu üstte olacak şekilde düz bir yüzeye yerleştirin (Şekil 1).Çözücü flakonunun mavi bir şeridi vardır. Mavi bir kapağı daha sonraki bir adımda talimatverilinceye kadar çıkarmayın. 5. Bir el BAXJECT III sistemindeki toz flakonunu tutarken, sistem tamamen çökene veçözücü toz flakonunun içine akana kadar diğer elinizle çözücü üzerine sıkıca bastırın (Şekil2). Aktarım tamamlanana kadar sistemi yatırmayın. 6. Çözücü aktarımının tamamlandığını doğrulayın. Tüm materyal çözünene kadar hafifçeçalkalayın (Şekil 3). Tozun tamamen çözündüğünden emin olun, aksi halde sulandırılançözeltilerin tümü cihaz filtresinden geçmeyecektir. Ürün hızlı bir şekilde çözünür(genellikle 1 dakikadan az). Sulandırıldıktan sonra çözelti berrak, renksiz ve yabancıpartikül içermiyor olmalıdır.
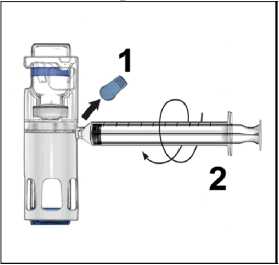
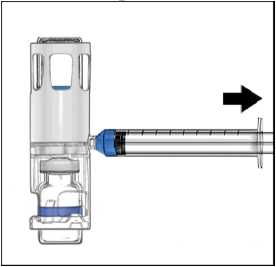
Enjeksiyon için talimatlarUygulama boyunca aseptik teknik (temiz ve düşük germ koşulları) gereklidir.Önemli Not: Hazırlanan çözeltiyi uygulamadan önce partikül madde ve renk değişikliği açısından inceleyin (çözelti berrak, renksiz ve partiküllerden arındırılmış olmalıdır). Çözelti tamamen berrak değilse veya tamamen çözülmediyse kullanmayın. 1. Mavi kapağı BAXJECT III cihazından çıkarın (Şekil 4). Şırınganın içine hava çekmeyin.Şırıngayı BAXJECT III cihazına bağlayın. Kit içerisinde yer alan Luer-lock şırıngakullanılması tavsiye edilir.2. Sistemi ters çevirin(toz flakon şimdi üstte). Pistonu yavaşça geri çekerek sulandırılmışçözeltiyi şırınganın içine çekin (Şekil 5).3. Şırıngayı çıkarın; şırıngaya kit içerisinde yer alan kelebek iğneyi takın ve sulandırılmışçözeltiyi damardan enjekte edin. Çözelti, hastanın konfor seviyesinin belirlediği hızda,dakikada 10 mL'yi geçmeyecek şekilde yavaşça uygulanmalıdır. (Bkz. Bölüm 4 Olası yanetkiler). 4. Kullanılmayan çözeltiyi uygun şekilde atın.  Aşağıdaki bilgiler yalnızca sağlık profesyonelleri içindir: Gereksinime göre tedavi Aşağıdaki kanama olayları söz konusu olduğunda, faktör VIII aktivitesi, karşılık gelen dönemde bilinen plazma aktivite seviyesinin (normalin %'sinde veya IU/dL) altınadüşmemelidir. Aşağıdaki tablo, kanama ataklarında ve ameliyatta dozlama kılavuzu olmasıaçısından kullanılabilir.
 Tablo2:Perioperatif Tedavi için DozajAmeliyat TürüGerekli Faktör VIIISeviyesi(normalin%'si veya IU/dL)Doz(IU/kg)Doz Sıklığı (saat)Tedavi SüresiMinörDiş çekimi dahil
60-100
30-50
Ameliyattan bir saat önce. Gerekirse 24 saat sonra tekrarlayın.
Tek doz veya kanama düzelinceyekadar gerektiğişekilde tekrarlayın. Majörİntrakraniyal, intraabdominalveya intratorasikcerrahi, eklemreplasman cerrahisi80-120 (pre vepostoperatif)
40-60
%100 aktivite elde etmek için operasyondan bir saat önce. FVIII aktivitesini hedef aralıkta içinde korumakiçin her 8 ila 24 saatte(<12 yaş hastalar için 6ila 24 saatte) birtekrarlayın
Yeterli yara iyileşmesine kadar Rutin ProfilaksiYetişkin ve adolesanlarda (12 yaş ve üstü) kg vücut ağırlığı başına haftada iki kez 40-50 IU uygulanır. Çocuklarda (<12 yaş), kg başına maksimum 70 IU olacak şekilde, kg vücut ağırlığı başına haftada iki kez 55 IU uygulanır. Doz ve doz aralıkları hastanın klinik yanıtına göre ayarlanır. Pediyatrik popülasyon:ADYNOVATE'in rutin profilakside ve kanama epizodlarının tedavisindeki güvenliliği ve etkililiği, çocuklar ve yetişkinler arasında benzerdir (Bkz. KÜB Bölüm 5.1).  |
İlaç BilgileriAdynovate 2000 Iu/5 Ml Iv Enjeksiyonluk Çözelti Hazırlamak İçin Liyofilize Toz ve ÇözücüEtken Maddesi: Rurioktokog Alfa Pegol (peglenmiş Rekombinant İnsan Koagülasyon Faktör Viii) Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.