Advate 500 Iu/5 Ml Iv Enjeksiyon İçin Liyofilize Toz İçeren Flakon Kullanma TalimatıKULLANMA TALİMATIADVATE 500 IU/5 mL IV enjeksiyon için liyofilize toz içeren flakon Damar içine uygulanır.SterilEtkin madde:Her bir flakonda 500 lU Oktokog alfa (rekombinant insan pıhtılaşmafaktörü VIII) Önerilen şekilde rekonstitüye edildiğinde mL başına 100 IU etkin madde elde edilir. Yardımcı maddeler:Mannitol, Sodyum klorür, Histidin, Trehaloz, Kalsiyum klorür,Trometamol, Polisorbat 80, Glutatyon (indirgenmiş) ve çözücü olarak steril enjeksiyonluk su. V Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Meydana gelen herhangi bir yan etkiyi raporlayarak yardımcı olabilirsiniz. Yanetkilerin nasıl raporlanacağını öğrenmek için 4. Bölümün sonuna bakabilirsiniz. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir. Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz. Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız. Bu ilaç kişisel olarak sizin için reçete edilmiştir, başkalarına vermeyiniz. Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde doktorunuza bu ilacıkullandığınızı söyleyiniz. Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışındayüksekveya düşükdoz kullanmayınız.Bu Kullanma Talimatında:1. ADVATE nedir ve ne için kullanıhr?2. AD VATE'i kullanmadan önce dikkat edilmesi gerekenler3. ADVATE nasıl kullanılır?4. Olası yan etkiler nelerdir?5. ADVATE'in saklanmasıBaşlıkları yer almaktadır.1. ADVATE nedir ve ne için kullanılır? ADVATE beyaz ila kirli beyaz arası dağılan bir toz içerir. Sulandırıldıktan sonra, çözeltiberrak, renksizdir ve yabancı partiküller bulundurmaz. ADVATE etken maddesi Oktokog alfa rekombinant DNA teknolojisi kullanılaraküretilmiş insan pıhtılaşma faktörü VIII'dir. Faktör VIII, kan pıhtısı oluşturmak ve kanamayı durdurmak için gereklidir. Hemofili A (doğuştan gelen faktör VIII eksikliği) hastalarında, Faktör VIII bulunmaz veya düzgün çalışmaz. ADVATE hemofili A hastalarında, kendiliğinden gerçekleşen veya ameliyat kaynaklıkanamaların önlenmesinde veya tedavisinde kullanılır. Oktokog alfa [İnsan koagülasyon faktör VIII (rDNA)] 2332 amino asitli saf bir proteindir.Kobay over [Chinese hamster ovary (CHO)] hücrelerinde rekombinant DNAteknolojisiyle üretilmiştir. Hücre kültürleme, saflaştırmada ya da son formülasyonaşamasında herhangi bir (ekzojen) insan -veya hayvan- kaynaklı protein eklenmeksizinhazırlanmıştır. 2. ADVATE kullanmadan önce dikkat edilmesi gerekenlerADVATE'i aşağıdaki durumlarda KULLANMAYINIZEğer; ADVATE'in içerdiği etkin madde olan Oktokog alfa'ya ya da yardımcı maddelerinealerjiniz varsa, Fare veya hamster proteinlerine alerjiniz varsa, ADVATE'i kullanmayınız. Alerjiniz olup olmadığından emin değilseniz, doktorunuza danışınız. ADVATE'i aşağıdaki durumlarda DİKKATLİ KULLANINIZBiyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. Eğer aşağıdaki durumlar sizde varsa, doktorunuz size ADVATE uygularken özel önlemler alacaktır: Önceden Faktör VIII ürünleriyle tedavi edildiyseniz, özellikle inhibitörler (vücudun alerji oluşturan maddeye karşı ürettiği antikor) geliştirdiyseniz, bu olayın tekrarlanma riski yüksekolabileceğinden doktorunuza söylemelisiniz. Faktör VlII'e karşı inhibitör oluşumu, hemofiliA hastalarının tedavisinde bilinen bir komplikasyondur. Bu inhibitörler, özellikle yüksekdüzeylerde, tedavinin düzgün bir şekilde çalışmasını durdurur. Siz veya çocuğunuz buinhibitörlerin gelişimi açısından dikkatli bir şekilde takip edileceksiniz. Sizin veyaçocuğunuzun kanaması ADVATE ile kontrol altına alınmıyorsa, acilen doktorunuzasöyleyiniz. Nadiren ADVATE kullanırken sizde anafilaktik bir reaksiyon (şiddetli ve ani bir alerjik reaksiyon) oluşabilir. Döküntü, bölgesel ya da yaygın kaşıntı, dil ve dudaklarda şişme, solukalmada zorluk, soluk alıp vermede ıslık çalar gibi sesler çıkması, göğüste sıkışma, genel birhastalık hali ile sersemlik hali gibi alerjik tepkinin erken belirtilerini tanıyor olmanızönemlidir. Bu belirtiler, aralarında aşırı sersemlik hali, bilincin bulanması ve soluk alıpvermenin ileri derecede zorlaşması gibi ek belirtileri bulunan anafilaktik şokun erkenbelirtileri olabilir. Bu belirtilerin herhangi birinin sizde görülmesi durumunda damar yoluyla uygulamaya hemen son vererek doktorunuza başvurunuz. Soluk alıp vermede zorluk ve neredeyse bayılmaolacakmış gibi sersemlik halinin de aralarında olduğu bu tür ağır belirtiler, uygun bir şekildeacilen tedavi edilmelidir.Faktör VIII inhibitörleri geliştiren hastalarİnhibitör (antikor) oluşumu tüm Faktör VIII ilaçları ile tedavi sırasında ortaya çıkabilecek bilinen bir komplikasyondur. Bu inhibitörler, özellikle yüksek düzeylerde, tedavinin düzgünbir şekilde çalışmasını durdurur. Siz veya çocuğunuz bu inhibitörlerin gelişimi açısındandikkatli bir şekilde takip edileceksiniz. Sizin veya çocuğunuzun kanaması ADVATE ilekontrol altına alınamıyorsa, derhal doktorunuza bilgi veriniz. Çocuklar Yukarıda sıralanmış bu uyarı ve önlemler hem erişkinler hem de çocuklar için geçerlidir. Bu uyarılar geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız. ADVATE'in yiyecek ve içecek ile kullanılmasıADVATE'in yiyecek ve içecek ile kullanılmasıyla ilgili herhangi bir ilişkisi bulunmamaktadır. Hamilelikhacı kullanmadan önce doktorunuza ya da eczacınıza danışınız.Hamileyseniz, hamile olabileceğinizi düşünüyorsanız veya gebelik planlıyorsanız, bu durumu doktorunuza bildiriniz. Doktorunuz, hamilelik sırasında ADVATE kullanıpkullanamayacağınıza karar verecektir. Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza danışınız.Emzirmehacı kullanmadan önce doktorunuza ya da eczacınıza danışınız.Bebeğinizi emziriyorsanız, bu durumu doktorunuza bildiriniz. Doktorunuz, emzirme sırasında ADVATE kullanıp kullanamayacağınıza karar verecektir. Araç ve makine kullanımıADVATE'in araç ya da makine kullanımı üzerinde herhangi bir etkisi bulunmamaktadır. ADVATE'in içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgilerBu tıbbi ürün her flakonda 10 mg sodyum (yemeklik tuzun ana bileşeni) içermektedir. Bu miktar, bir yetişkin için Dünya Sağlık Örgütü (WHO) tarafından önerilen maksimum günlük sodyum alımının %0.5'ine eşdeğerdir. Diğer ilaçlar ile birlikte kullanımıADVATE ile diğer tıbbi ürünlerin etkileşimi olup olmadığını araştıran bir çalışma yapılmamıştır. Eğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlardakullandınız ise lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.3. ADVATE nasıl kullanılır?Uygun kullanım ve doz/uygulama sıklığı için talimatlar:ADVATE ile tedavi, hemofili A hastalarının bakımında deneyimli olan doktorlar tarafından başlatılacaktır. ADVATE dozunu (uluslararası birimler veya IU) doktorunuz, sizin durumunuza ve vücut ağırlığınıza ve kanamanın tedavisi veya kanamayı önleme amaçlı kullanılıp kullanılmadığınagöre hesaplayacaktır. Uygulama sıklığı ADVATE'in sizin üzerinizde ne kadar işe yaradığınabağlı olacaktır. Genellikle, ADVATE ile yerine koyma terapisi uzun süreli bir tedavidir. Bu ilacı her zaman için doktorunuzun size anlattığı şekilde kullanınız. Emin değilseniz, doktorunuza danışınız. Kanamanın önlenmesiOlağan oktokog alfa dozu her 2-3 günde bir, bir kg vücut ağırlığı başına 20-40 IU'dur. Ancak bazı durumlarda, özellikle küçük yaştaki hastalarda daha sık enjeksiyonlar veya daha yüksekdozlar gerekebilir. Kanamanın tedavisiOktokog alfa dozu vücut ağırlığına ve elde edilecek faktör VIII seviyelerine bağlı olarak hesaplanmaktadır. Hedef faktör VIII seviyeleri kanamanın ciddiyeti ve yerine bağlı olacaktır. Doz (IU) = vücut ağırlığı (kg) x istenen Faktör VIII artışı (normale göre %) x 0.5 ADVATE'in etkisinin yetersiz olduğunu düşünüyorsanız, doktorunuza danışınız. Doktorunuz yeterli Faktör VIII seviyelerine sahip olmanızı sağlamak için uygun laboratuvar testleri gerçekleştirecektir. Bu durum özellikle büyük bir ameliyat geçiriyorsanız önemlidir. Uygulama yolu ve metodu:ADVATE genellikle doktorunuz veya hemşireniz tarafından damar içine (intravenöz) enjekte edilir. ADVATE'i başka biri veya kendiniz enjekte edecekseniz, önce yeterli eğitimin alınmışolması gerekmektedir. Ürünü kendi kendinize uygulamanız için gerekli talimatlar, bukullanma talimatının sonunda verilmektedir. Değişik yaş grupları:Çocuklarda kullanımı:ADVATE'in çocuklardaki kanamanın tedavisi için uygulanacak dozu erişkinlerdeki doz ile aynıdır. Altı yaşından küçük çocuklarda kanamaların önlenmesi için haftada 3 ila 4 defa,vücut ağırlığının her bir kg'ı başına 20-50 IU dozunda uygulanması önerilir. ADVATE'inçocuklarda uygulaması (intravenöz yoldan) yetişkinlerdeki uygulamadan farklı değildir.Faktör VIII ürünlerinin sık infüzyonuna olanak vermek için bir Santral Venöz Kateter (SVK)gerekli olabilir. Yaşlılarda kullanımı:Özel kullanımı yoktur. Özel kullanım durumları:Böbrek ve karaciğer yetmezliği:Özel kullanımı yoktur. Eğer ADVATE'in etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise, doktorunuz veya eczacınız ile konuşunuz.Kullanmanız gerekenden daha fazla ADVATE kullandıysanız:ADVATE'i her zaman doktorunuzun tam olarak size söylediği gibi alınız. Eğer emin değilseniz doktorunuzla kontrol etmelisiniz. ADVATE'den kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.ADVATE'i kullanmayı unutursanız:ADVATE'i kullanmayı unutursanız, unuttuğunuz doz için çift doz enjekte etmeyiniz. Planlanmış bir sonraki enjeksiyonla tedavinize yeniden başlayarak, doktorunuzun önerileridoğrultusunda devam ediniz. Unutulan dozları dengelemek için çift doz almayınız.ADVATE ile tedavi sonlandırıldığındaki oluşabilecek etkiler:Doktorunuza danışmadan ADVATE kullanmayı bırakmayınız. 4. Olası yan etkiler nelerdir?Tüm ilaçlar gibi, ADVATE'in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir. Aşağıdakilerden biri olursa, ADVATE'i kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:Aşırı duyarlılık ya da alerjik reaksiyonlar (bunlar arasında dudaklarda, dilde, deride ve iç organlarda şişme (anjiyoödem), uygulama bölgesinde yanma ve batma, titreme, sıcakbasması, döküntü, kurdeşen, vücutta kabarcıklar, yaygın kaşıntı, baş ağrısı, kan basıncındadüşme, genel olarak keyifsiz hissetme, letarji (sürekli uyku hali), bulantı, huzursuzluk, kalpçarpıntısı, karıncalanma, solunum sıkıntısı, hırıltılı solunum, göğüste sıkışma hissi, kusma,sersemlik, baş dönmesi ve bilinç kaybı (şok dahil) yer alabilir) Solunum sıkıntısı ve kendinizi bayılacakmış gibi hissetme gibi ağır belirtilerin, acilen tedavi edilmesi gerekir. Bunların hepsi çok ciddi yan etkilerdir. Eğer bunlardan biri sizde mevcut ise, sizin ADVATE'e karşı ciddi alerjiniz var demektir. Acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerek olabilir. İnhibitör antikorları, önceden Faktör VIII ilaçları ile tedavi edilmemiş çocuklarda, (bkz. bölüm ADVATE'i aşağıdaki durumlarda DİKKATLİ KULLANINIZ) çok yaygın birşekilde oluşabilir (1/10 hastanın üzerinde); bununla birlikte, Faktör VIII ile önceden tedaviedilmiş (150 günden fazla süren tedavi) hastalarda ise risk yaygın değildir (1/100hastanın altında). Bu durumda, sizin veya çocuğunuzun ilacı istenilen etkiyioluşturmayabilir ve siz veya çocuğunuzda geçmeyen kanama meydana gelebilir. Bu durumda,derhal doktorunuzla iletişime geçmelisiniz. Yan etkiler aşağıdaki kategorilerde gösterildiği şekilde sıralanmıştır:
Çok yaygın Yaygın
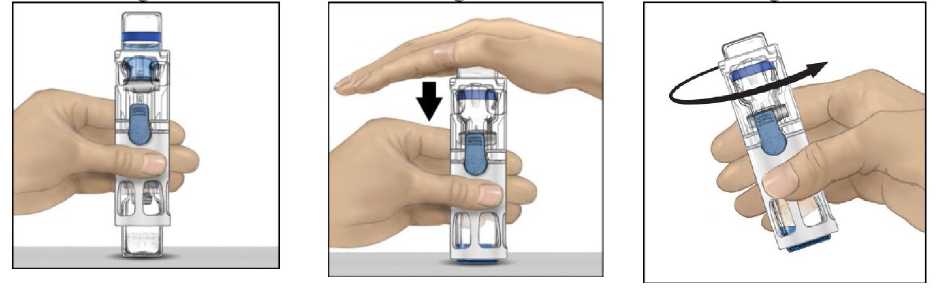
Yaygın olmayan SeyrekÇok seyrekBilinmiyor 10 hastanın en az 1'inde görülebilir. 10 hastanın birinden az, fakat 100 hastanın birinden fazla görülebilir. Eldeki verilerden hareketle tahmin edilemiyor. Çok yaygın:- Faktör VIII inhibisyonu (vücudun Faktör VIII'e karşı antikor (inhibitör) üretmesi) (HTGH)* Yaygın:- Baş ağrısı, - Ateş. Yaygın olmayan:- Faktör VIII inhibisyonu (vücudun Faktör VIII'e karşı antikor (inhibitör) üretmesi)(TGH)* - Sersemlik hali, - Nezle / grip hali, - Bayılma, - Anormal kalp atışları, - Ciltte kızarık ve kaşıntılı kabarcıklar, - Göğüste rahatsızlık hissi, - Enjeksiyon yapılan yerde morarma, - Enjeksiyon yapılan yerde reaksiyon, - Kaşıntı, - Terlemede artış, - Ağızda farklı tat, - Ateş basması, - Migren, - Unutkanlık, - Üşüme / titreme, - İshal, - Mide bulantısı, - Kusma, - Nefes darlığı, - Boğaz ağrısı, - Lenf damarlarında enfeksiyon, - Ciltte beyazlama, - Göz iltihaplanması, - Döküntüler, - Aşırı terleme, - Ayak ve bacaklarda şişkinlik, - Kırmızı kan hücreleri yüzdesinde azalma, - Beyaz kan hücrelerinin bir türünde (monosit) artış, - Karnın üst kısmı veya göğsün aşağı kısmında ağrı. Ameliyat ile ilgili- Kateterle ilişkili enfeksiyon, - Kırmızı kan hücreleri sayısında azalma, - Kol ve eklemlerde şişkinlik, - Diren çekme işleminden sonra kanama süresinde uzama, - Faktör VIII seviyesinde azalma, - Operasyon sonrası morarma. Santral Venöz Kateter (SVK) ile ilgili- Kateterle ilişkili enfeksiyon, - Sistemik (vücutta birden fazla bölgesinde olan) enfeksiyon, - Kateter bölgesinde yerel pıhtı oluşumu. Bilinmiyor:- Potansiyel olarak hayatı tehdit edici reaksiyonlar (anafilaksi), - Diğer alerjik reaksiyonlar (aşırı duyarlılık), - Genel rahatsızlıklar (yorgunluk, enerji eksikliği). *HTGH(Dahaöncehiçtedavigörmemişhastalar)klinikçalışmalarında raporedilmiştir. TGH'de (Daha önce tedavi görmüş hastalar) rapor edilmiştir. Çocuklarda görülen ek yan etkiler:- Klinik çalışmalarda daha önceden tedavi görmemiş çocuk hastalarda inhibitör gelişmesive uygulamanın yapıldığı kateterle ilişkili komplikasyonlar dışında, yan etkilerde yaşaözgü farklılıklar görülmemiştir. Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız doktorunuzu veya eczacınızı bilgilendiriniz.Yan etkilerin raporlanmasıKullanma Talimatında yer alan veya almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yanetkileri www.titck.gov.tr sitesinde yer alan İlaç Yan Etki Bildirimi ikonuna tıklayarak ya da0 800 314 00 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacın güvenliliği hakkında daha fazla bilgi edinilmesine katkı sağlamış olacaksınız. 5. ADVATE'in saklanmasıADVATE'i çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.Her bir ambalaj, kapalı bir blisterde bir kullanıma hazır BAXJECT III sistemi (sulandırma için sistem ile önceden birleştirilmiş toz flakonu ve 5 mL çözücü içeren flakon) uygulama seti kapsamında kelebek iğneli infüzyon seti ve tek kullanımlık enjektör içerir. A^VATE'i son kullanma tarihinden sonra kullanmayınız. Son kullanma tarihi belirtilmişayın son günüdür. A^VATE'i buzdolabında (2°C ila 8°C arasında sıcaklıkta) saklayınız. Dondurmayınız. Ürün içeren blister raf ömrü boyunca 6 aylık bir süreyle 25°C'a kadar oda sıcaklığındasaklanabilir. Bu durumda, bu ilacın kullanımı, bu 6 aylık periyodun sonunda veya ürünüzerinde yazılı olan son kullanım tarihinden hangisi önceyse ona göre sona erer. Lütfenoda sıcaklığına çıkartıldığı tarihi ürün ambalajı üzerine kaydediniz. Ürün bir kez odasıcaklığında saklanmaya başlandıktan sonra yeniden buzdolabına konulmamalıdır. Işıktan korumak için ürün içeren blisteri orijinal ambalajı içinde saklayınız. Bu ilaç yalnızca tek kullanımlıktır. Kullanılmayan çözeltiyi uygun bir şekilde atınız. Toz tamamen çözündüğünde ürünü hemen kullanınız. Rekonstitüye edildikten sonra 25°C altında saklanmak koşuluyla 3 saat içerisindekullanılmalıdır. Rekonstitüye edildikten sonra buzdolabında saklamayınız. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilikve İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz. Son kullanma tarihiyle uyumlu olarak kullanınız.Ambalajdaki son kullanma tarihinden sonra ADVATE'i kullanmayınız.Ruhsat sahibi:Üretim Yeri:Takeda İlaç Sağlık Sanayi Ticaret Limited Şirketi Levent-Şişli/İSTANBUL Baxalta Manufacturing Sarl, Neuchatel /İSVİÇRE Bu kullanma talimatı en son tarihinde onaylanmıştır.AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR ADVATE başka ilaç ya da çözücülerle karıştırılmamalıdır. Her ADVATE uygulamasında, ürünün adı ve parti numarasının kaydedilmesi önerilir. Sulandırma için talimatlar: Ambalajdaki son kullanma tarihinden sonra ADVATE'i kullanmayınız. Blister üzerindeki kapak tamamen kapatılmamışsa kullanmayınız. Sulandırma sonrasında çözeltiyi buzdolabına koymayınız. 1. Ürün hala soğutucuda saklanıyorsa, kapalı blisteri (sulandırma sistemi ile öncedenbirleştirilmiş toz ve çözücü şişeleri içeren) buzdolabından alın ve oda sıcaklığına (15oC ile25°C arasında) ulaşmasını sağlayınız. 2. Ellerinizi sabun ve ılık su ile iyice yıkayınız. 3. Etiketi soyarak ADVATE ambalajını açın. BAXJECT III sistemini blisterden çıkarınız. 4. ADVATE'i, seyreltici flakonu üstte olacak şekilde düz bir yüzeye yerleştiriniz (Şekil 1).Seyreltici flakonunun mavi bir şeridi vardır. Mavi bir kapağı daha sonraki bir adımdatalimat verilinceye kadar çıkarmayınız. 5. Bir eliniz BAXJECT III sistemindeki ADVATE'yi tutarken, sistem tamamen çökene ve seyreltici ADVATE flakonunun içine akana kadar diğer elinizle seyreltici flakonu üzerinesıkıca bastırınız (Şekil 2). Aktarım tamamlanana kadar sistemi eğmeyiniz. 6. Seyreltici aktarımının tamamlandığını doğrulayınız. Tüm materyal çözünene kadaryavaşça döndürünüz. ADVATE tozunun tamamen çözündüğünden emin olunuz, aksihalde sulandırılan çözeltilerin tümü cihaz filtresinden geçmeyecektir. Ürün hızlı birşekilde çözünür (genellikle 1 dakikadan az). Sulandırıldıktan sonra çözelti berrak, renksizve yabancı partikül içermiyor olmalıdır.
Enjeksiyon için talimatlar:Uygulama sırasında aseptik (her türlü mikroptan arındırılmış) teknik gereklidir. Uygulama için luer kilitli bir enjektör gerekmektedir. Önemli not:Doktorunuz ya da hemşireniz tarafından bu iş için özel eğitim almamışsanız kendikendinize enjeksiyon uygulamayınız. Uygulama öncesinde hazırlanmış çözeltinin herhangi bir parçacık içerip içermediği yada renk değişikliği olup olmadığını gözle kontrol ediniz (çözelti berrak, renksiz olmalıve yabancı parçacıklar içermemelidir). Çözelti tam olarak berrak değilse ya da tümüyleçözülmediyse ADVATE'i kullanmayınız. 1. Mavi kapağı BAXJECT III cihazından ayırınız. ENJEKTÖRE HAVA ÇEKMEYİNİZ.Enjektörü BAXJECT III cihazına bağlayınız. 2. Sistemi ters çeviriniz (sulandırılmış çözeltinin bulunduğu flakon üstte olmalıdır). Pistonuyavaşça geri çekerek enjektöre sulandırılmış çözeltiyi çekiniz. 3. Enjektörü ayırınız. 4. Enjektöre kelebek iğne takınız ve sulandırılmış çözeltiyi damar içine enjekte ediniz.Çözelti hastanın konfor seviyesine göre, dakikada 10 mL seviyesini geçmeyecek şekilde,yavaşça uygulanmalıdır. ADVATE uygulaması öncesinde ve sonrasında nabızölçülmelidir. Önemli bir artış meydana gelirse uygulama hızının düşürülmesi veyaenjeksiyona geçici olarak ara verilmesi genellikle semptomların hızlıca giderilmesinisağlamaktadır (bkz. Bölüm 2. ADVATE'i aşağıdaki durumlarda DİKKATLİKULLANINIZ ve 4. Olası yan etkiler nelerdir?). 5. Kullanılmamış herhangi çözeltiyi uygun şekilde bertaraf ediniz. Pozoloji/uygulama sıklığı ve süresi:Kanadıkça tedaviFaktör VIII (FVIII) dozu, faktör VIII ürünleri için geçerli WHO standardına uygun olarak Uluslararası Birimlerde (IU) ifade edilmektedir. Plazmada Faktör VIII dozu yüzde (normalinsan plazmasına göre) veya IU (plazmada faktör VIII için uluslararası standart) olarak ifadeedilmektedir. Bir IU faktör VIII aktivitesi bir ml normal insan plazmasındaki faktör VIII miktarına karşılık gelmektedir. Gerekli faktör VIII dozunun hesaplaması bir kilo vücut ağırlığı başına 1 IUfaktör VIII'ün plazma faktör VIII aktivitesini 2 IU/dL arttırdığı yönündeki gözlemsel bulguyadayanmaktadır. Doz aşağıdaki formüle göre belirlenir: Gerekli doz (IU) = vücut ağırlığı (kg) x istenen faktör VIII artışı (%) x 0.5Aşağıdaki hemorajik olayların gerçekleşmesi durumunda, faktör VIII aktivitesi ilgili dönemde belirtilen plazma aktivitesi seviyesinin (normal seviyenin %'si veya IU/dl) altınadüşmemelidir. Aşağıda sunulan Tablo, kanama episodları ve cerrahide dozaj belirlenmesindekullanılabilir:
|
İlaç BilgileriAdvate 500 Iu/5 Ml Iv Enjeksiyon İçin Liyofilize Toz İçeren FlakonEtken Maddesi: Oktokog Alfa Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.