Feiba 500 U Iv İnfüzyon İçin Liyofilize Toz İçeren Flakon Kullanma TalimatıKULLANMA TALİMATI FEIBA 500 U IV infüzyon için liyofilize toz içeren flakonDamar içine (intravenöz) uygulanır.SterilEtkin madde:Her bir flakon 500 ünite Faktör VIII İnhibitör By-pass Aktivitesinesahip 200-600 mg insan plazma proteini içerir. FEIBA bileşiminde aktive Faktör VII yanında büyük bölümü aktif olmayan formda Faktör II, IX ve X bulunmaktadır. Her bir ünite FEIBA, 0,1 ünite kadar Faktör VIII koagülan antijeni (F VIIIC:Ag) içerir. Kallikrein-kinin sisteminin faktörleri ancak eser miktarlarda bulunmaktadır.Önerilen şekilde rekonstitüye edildiğinde mL başına yaklaşık 50 ünite etkin madde elde edilir. Yardımcı maddeler:Sodyum klorür, sodyum sitrat, enjeksiyonluk su.¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Meydana gelen herhangi bir yan etkiyi raporlayarak yardımcı olabilirsiniz. Yanetkilerin nasıl raporlanacağını öğrenmek için 4. Bölüm'ün sonuna bakabilirsiniz. Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir. Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz. Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız. Bu ilaç kişisel olarak sizin için reçetelendirilmiştir, başkalarına vermeyiniz. Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde bu ilacıkullandığınızı doktorunuza söyleyiniz. Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışındayüksek veya düşükdoz kullanmayınız.Bu Kullanma Talimatında:1. FEIBA nedir ve ne için kullanılır?2. FEIBA 'yı kullanmadan önce dikkat edilmesi gerekenler3. FEIBA nasıl kullanılır?4. Olası yan etkiler nelerdir?5. FEIBA 'nın saklanmasıBaşlıkları yer almaktadır.1. FEIBA nedir ve ne için kullanılır?FEIBA, beyaz-beyaza yakın ya da soluk yeşil renkte tozdur. Steril enjeksiyonluk su ile sulandırıldıktan sonra ürün, intravenöz kullanım için tasarlanmıştır. 1FEIBA insan plazmasından yapılmıştır. FEIBA, inhibitör gelişmiş hemofili A hastalarında spontan kanamaların tedavisinde ve cerrahi operasyonlarında, Hemofili hastası olmayıp Faktör VIII'e karşı edinsel inhibitör gelişmiş hastaların spontan kanamalarında ve cerrahi operasyonlarında, FEIBA, yüksek yanıtlı inhibitörü olan ve sık eklem kanaması olan hemofili A hastalarının kanamalarının önlenmesinde, Faktör IX eksikliği olan inhibitör geliştirmiş hastaların kanama tedavisi ve cerrahisi için kullanılabilecek alternatiflerin azlığı ve ilacın etki mekanizması dikkate alındığında, eğerspesifik başka bir tedavisi mevcut değilse, inhibitör gelişmiş hemofili B hastalarındakanamaların tedavisinde ve cerrahisinde endikedir. 2. FEIBA'yı kullanmadan önce dikkat edilmesi gerekenlerBilinen bir alerjiniz var ise doktorunuzu bilgilendiriniz. Düşük sodyum diyetindeiseniz doktorunuzu bilgilendiriniz. FEIBA'yı aşağıdaki durumlarda KULLANMAYINIZAşağıdaki durumlarda FEIBA yalnızca uygun pıhtılaşma faktörü konsantreleri kullanılarak yapılan tedaviye yanıt alınamadığında (örneğin çok yüksek bir inhibitör titresi varlığına bağlıolarak) kullanılabilir. Eğer FEIBA'nın içerdiği maddelerden herhangi birine karşı alerjiniz (aşırı duyarlılığınız)varsa. Eğer sizde yaygın damar içi pıhtılaşma durumu varsa (Disemine İntravaskülerKoagülasyon ya da DIC olarak da adlandırılan ve yaşamı tehdit eden bu hastalıkta kan,damarlar içinde aşırı pıhtılaşır. Bu durum daha sonra tüm vücuttaki pıhtılaşma faktörlerinintüketilmesine neden olur). Kalp krizi (miyokard infarktüsü), aniden kan damarları içinde pıhtı oluşumu (akut tromboz)ve/veya oluşan bu pıhtıların daha küçük damarları tıkaması (embolizm): Bu hastalardaFEIBA yalnızca yaşamı tehdit eden kanamalarda kullanılmalıdır. 2FEIBA'yı aşağıdaki durumlarda DİKKATLİ KULLANINIZFEIBA insan kanının sıvı olan kısmından (plazmasından) elde edilir. Bu nedenle pek çok insanın kanı toplanmakta ve bu kanların plazmasından yararlanılmaktadır. İlaçlar insanplazmasından üretildiğinde, hastalara geçebilecek enfeksiyon ajanlarını önlemek için birdizi önlemler alınır. Bu önlemler, hastalık taşıma riski olan kan vericilerini saptamak vedışarıda bırakıldıklarından emin olmak için, plazma vericilerinin dikkatli bir şekildeseçimini ve her bir kan bağışının ve plazma havuzlarının, virüs/enfeksiyon belirtileriaçısından test edilmesini içerir. Bu ürünlerin üreticileri ayrıca, plazmanın işlenmesisürecine virüsleri arındıracak ya da etkisiz hale getirecek basamakları da dahil ederler.Bütün bu önlemlere rağmen, insan plazmasından hazırlanan ilaçlar insanlara uygulandığında, bir enfeksiyonun bulaşma olasılığı tamamen ortadan kaldırılamaz. Buayrıca bilinen virüsler (AIDS'e neden olan HIV virüsü, karaciğer hastalığına neden olanHepatit A, Hepatit B ve Hepatit C virüsleri, parvovirüs B19 gibi zarfsız virüsler) ya dasonrada ortaya çıkan virüsler veya Creutzfeld-Jacobs hastalığı gibi diğer enfeksiyonçeşitleri için de geçerlidir.Bu nedenle ileride oluşabilecek bir hastalıkla kullanılmış ürün arasındaki bağlantıyı kurabilmek için, kullandığınız ürünün adı ve seri numarasını kaydederek bu kayıtlarısaklayınız.Eğer aşağıdakilerden biri sizde mevcut ise FEIBA'yı kullanmadan önce doktorunuz, hemşireniz veya eczacınızla konuşunuz: Karaciğer problemleriniz varsa, Kalp krizi geçirdiyseniz, Kanınızda pıhtı (tromboz veya embolizm) varsa, Bağışıklık sisteminiz düzgün çalışmıyorsa Düşük sodyum diyetindeyseniz. Bazı insanlar FEIBA kullanırken aşağıdaki yan etkileri yaşamıştır. Yüksek dozlarda FEIBA kullanıyorsanız, bu yan etkilere yakalanma riskiniz artar: Yaygın damar içi pıhtılaşma (DIC) (testlerde gösterilmiştir) Damarlarda veya akciğerlerde kan pıhtıları Kalp krizi Felç. Damar içine uygulanan herhangi bir plazma kaynaklı üründe olduğu gibi, alerjik tipte aşırı duyarlılık reaksiyonları görülebileceğinden, alerjik tipteki tepkileri olur olmaz tanıyabilmenizaçısından aşağıdaki aşırı olası duyarlılık reaksiyonlarının erken belirtileri konusunda uyanıkolmalısınız: 3- Eritem (deride kızarma) - Deri döküntüsü - Deride yaygın kabarıklıklar oluşması (döküntü/kurdeşen) - Tüm vücutta kaşıntıDudak ve dilde şişme - Solunum zorluğu / zorlu soluk alıp verme (dispne) - Göğüste sıkışma hissi - Genel bir keyifsizlik durumu - Baş dönmesi/sersemlik hali - Tansiyonunuzda düşme Plazma kaynaklı ürünlere karşı gelişen aşırı duyarlılık reaksiyonlarının diğer semptomlarına halsizlik ve huzursuzluk dahildir. Bu belirtilerden herhangi birini fark ederseniz uygulamayı durdurarak hemen doktorunuza başvurunuz. Bu belirtiler anafilaktik şok denilen bir durumun erken habercileri olabilir. Ağırbelirtilerin acil tedavisinin yapılması gerekir. Bu ilaca ya da bileşimindeki maddelerden herhangi birine aşırı duyarlı olduğunuzdan kuşkulanılmışsa doktorunuz sizde FEIBA'yı ancak bu ilaçtan beklenen fayda ile bu ilacı yenidenkullanmanızın ve/veya diğer koruyucu tedaviler veya alternatif tedavi edici ajanları kullanmanızınoluşturacağı riski dikkatle karşılaştırarak uygulayacaktır. - Kan basıncınızda ya da kalbinizin atım hızında önemli değişiklikler olursa, solunum zorluğuçekerseniz, öksürük veya göğüs ağrınız olursa uygulamayı hemen durdurarak doktorunuzabaşvurunuz. Doktorunuz, uygun tanısal yöntemleri kullanarak tedavinizi yapacaktır. - İnhibitör gelişmiş hemofili hastasıysanız ya da pıhtılaşma faktörlerine karşı sonradankazanılmış inhibitörleriniz varsa. FEIBA tedavisi alan bu tür hastalarda hem kanamaya hemde damar içinde pıhtılaşmaya (tromboz) eğilim artabilir. FEIBA tedavisi sırasında kan damarları içinde pıhtı oluşumu ve oluşan bu pıhtıların daha küçük damarları tıkamasına bağlı olarak aralarında yaygın damar içi pıhtılaşma (DIC), toplardamarlardapıhtı birikimi, akciğer damarlarının tıkanması (pulmoner embolizm), miyokard enfarktüsü (kalpkrizi) ve inme dahil bazı trombotik ve tromboembolik olaylar görülebilir. Eş zamanlı rekombinantFaktör VIIa kullanan hastalarda tromboembolik olay gelişim riski artabilir. . Tromboembolikolayların bazıları FEIBA'nın yüksek dozları ile tedavi durumunda gerçekleşmiştir. Başka bir firma tarafından emisizumab (hemofili A hastalarında kanamaları önlemek için kullanılan bir ilaç) ile yapılan bir araştırmada, ani kanamalar yaşayan bazı hastalar kanamaları kontrol altınaalmak için FEIBA ila tedavi edilmiştir ve bu hastaların birkaçı trombotik mikroanjiopati (TMA)geliştirmiştir. TMA ciddi ve potansiyel olarak yaşamı tehdit edici bir durumdur. İnsanlar bu durumugeliştirdiğinde, kan damarı zarları hasar görebilir ve küçük damarlarda pıhtılar oluşabilir. Bazıolgularda bu durum böbrekler ve diğer organlarda hasara neden olabilir. Emisizumab profilaksisisırasında ani kanamaların olması durumunda, derhal hemofili tedavisi uygulayan hekiminizle veya 4Hemofili Tedavi Merkezinizle iletişime geçiniz. İnsan kanı ve plazmasından hazırlanan tıbbi ürünlerinde, hastalara enfeksiyon geçmesini önlemek için ciddi önlemler alınır. Bu önlemler arasında enfeksiyon taşıma riskinin önlenmesinden eminolmak için tüm kan ve plazma donörlerin dikkatli seçimi ve virüs/enfeksiyon işaretleri için herbağışın ve plazma havuzlarının test edilmesi yer almaktadır. Bu ürünlerin üreticileri ayrıca insankanı ve plazmasında virüslerin inaktivasyonu veya uzaklaştırılması için işlem adımlarıeklemektedirler. Buna rağmen insan kanı ya da plazmasından hazırlanan tıbbi ürünleruygulandığında, enfeksiyon ajanlarının bulaşma olasılığı tam olarak ortadan kaldırılamayabilir. Budurum henüz bilinmeyen ya da yeni ortaya çıkan virüsler ve diğer hastalık etkenleri için degeçerlidir. Alınan önlemlerin insan immün yetmezlik virüsü (HIV), hepatit B virüsü ve hepatit C virüsü gibi zarflı virüslerle hepatit A virüsü gibi zarfsız virüsler için etkili olduğu düşünülmektedir. Alınanönlemlerin Parvovirüs B19 gibi bazı zarfsız virüsleri uzaklaştırmak ya da inaktive etmek için etkisiise kısıtlıdır. Parvovirus B19 enfeksiyonu gebe kadınları (fetüste enfeksiyona nedenolabilmektedir), immün yetmezlikli hastaları veya bazı kansızlık tiplerini (örn. orak hücre anemisiveya hemolitik anemi durumu) ciddi olarak etkilemektedir. Düzenli veya tekrarlı bir şekilde insan türevli Faktör VIII inhibitörleri alıyorsanız doktorunuz, hastalık yapıcı etkenlerin size bulaşmasını önlemek için uygun aşılarınızı (Hepatit A, Hepatit B vb.)yaptırmanızı önerebilir. Yüksek dozlarda FEIBA uygulamasından sonra, pasif olarak transfer edilen Hepatit B yüzey antikorunun geçişinin artması, serolojik testlerde pozitif sonucunun yanlış yorumlanmasına nedenolabilir. FEIBA plazma türevi bir üründür ve hastalara verildiğinde izohemaglütininlerin (başka bir kişiden alınan alyuvarların yapışmasına neden olan antikorlar) oluşmasına neden olan maddeler içerebilir.Bu süreç kan testlerinde yanıltıcı sonuçlar alınmasına yol açabilmektedir. Kullanmış olduğunuz ürünlerin bir listesini tutabilmeniz açısından kullandığınız her FEIBA dozundan sonra ürünün adı ve parti numarasını kaydetmeniz önemle önerilmektedir. İnhibitör (antikor) oluşumu tüm Faktör VIII ilaçları ile tedavi sırasında ortaya çıkabilecek bilinen bir komplikasyondur. Bu inhibitörler, özellikle yüksek düzeylerde, tedavinin düzgün bir şekildeçalışmasını durdurur. Siz veya çocuğunuz bu inhibitörlerin gelişimi açısından dikkatli bir şekildetakip edileceksiniz. Sizin veya çocuğunuzun kanaması FEIBA ile kontrol altına alınamıyorsa,derhal doktorunuza bilgi veriniz. Bu uyarılar, geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız. 5FEIBA'nın yiyecek ve içecek ile kullanılmasıFEIBA'nın yiyecek ve içecekler ile etkileşimi yoktur. Hamilelikİlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.FEIBA'nın hamilelik sırasında kullanılıp kullanılamayacağına doktorunuz karar verecektir. Hamilelik sırasında artan tromboz riski nedeniyle, FEIBA yalnızca dikkatli tıbbi gözlem altında veyalnızca kesinlikle gerekliyse uygulanmalıdır. Parvovirüs B19 adı verilen virüsün neden olduğu enfeksiyon ile ilgili bilgi için FEIBA'yı aşağıdaki durumlarda DİKKATLİ KULLANINIZ bölümüne bakınız. Doğum kontrol yöntemleri ile herhangi bir etkileşim bildirilmemiştir. Doktorunuz FEIBA'nın ve bazı hormonal doğum kontrol yöntemlerinin protrombotik risklerini göz önünde bulundurarakuygun bir doğum kontrol yöntemine karar verecektir. Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınız.Emzirmeİlacı kullanmadan önce doktorunuza ya da eczacınıza danışınız.FEIBA'nın emzirme döneminde kullanılıp kullanılamayacağına doktorunuz karar verecektir. FEIBA emziren annelerde kullanılmamalıdır. Araç ve makine kullanımıFEIBA'nın araç ve makine kullanımı yeteneğini etkileyebileceğine dair herhangi bir işaret yoktur. FEIBA'nın içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgilerFEIBA flakonunda yaklaşık 40 mg sodyum (hesaplanmış değer) içerir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. Bu miktar, bir yetişkin için Dünya Sağlık Örgütü (WHO) tarafından önerilen maksimum günlük 2 g sodyum alımının %2'sine eşdeğerdir. Diğer ilaçlar ile birlikte kullanımıReçetesiz alınan ilaçlar da dahil olmak üzere başka herhangi bir ilaç alıyorsanız veya yakın zamanda aldıysanız lütfen doktorunuza bildiriniz. FEIBA ve rekombinant Faktör VIIa (inhibitörlü hemofili hastalarında kullanılabilen bir diğer ilaç), antifibrinolitiklerin (pıhtı oluşumunu kolaylaştıran ilaçlar) veya emisizumabın_birlikte veya art ardakullanımı ile ilgili yeterli ve kontrollü çalışmalar yürütülmemiştir. FEIBA tedavisi ile traneksamik 6asit ve aminokaproik asit gibi sistemik antifibrinolitikler birlikte kullanıldığında, trombotik olayların (kanın damar içinde pıhtılaşmasına bağlı olaylar) olasılığı dikkate alınmalıdır. Bu nedenle,FEIBA uygulamasından sonra yaklaşık 6 ila 12 saatlik sürede antifibrinolitikler kullanılmamalıdır. FEIBA ile rekombinant Faktör VlIa'nın eş zamanlı kullanımı durumunda, mevcut deneysel (in vitro)verilere ve klinik gözlemlere göre potansiyel olarak tromboembolik olayla (damarlarda kanpıhtısı oluşma olayı) sonuçlanabilecek bir ilaç etkileşimi göz ardı edilemez. Emisizumab (hemofiliA hastalarında kanamaları önlemek için kullanılan bir ilaç) aldıktan sonra FEIBA tedavisigörecekseniz doktorunuza söyleyiniz; bu durumda göz önünde bulundurulması gereken özeluyarılar ve önlemler bulunmaktadır. Doktorunuzun sizi yakından izlemesi gerekecektir.Tüm kan pıhtılaşma ürünlerinde geçerli olduğu gibi, FEIBA'nın da uygulamadan önce başka ilaçlarla karıştırılması etkililiğini ve ilaca toleransınızı bozabilir. Uygulama diğer ilaçların da ortakolarak uygulandığı bir venöz setten yapılıyorsa, FEIBA uygulamadan önce ve sonra bu uygulamasetinin, fizyolojik tuzlu su gibi uygun çözeltilerle yıkanması önerilmektedir. Eğer reçeteli ya da reçetesiz herhangi bir ilacı şu anda kullanıyorsanız veya son zamanlarda kullandınız ise lütfen doktorunuza veya eczacınıza bunlar hakkında bilgi veriniz.3. FEIBA nasıl kullanılır?-Uygun kullanım ve doz/uygulama sıklığı için talimatlar:Doktorunuz hastalığınıza bağlı olarak ilacınızın dozunu belirleyecek ve size uygulayacaktır. Doktorunuz size uygulanacak dozu ve uygulamanın hangi sıklıkta yapılacağını bireysel olarakbelirlemek için sizdeki pıhtılaşma bozukluğunun şiddetini, sizdeki kanamanın nereden ve neşiddette olduğunu ve sizin genel durumunuzu dikkate alacaktır. Doktorunuzca belirlenmiş bu dozajıdeğiştirmeyiniz ve kendisine sormadan uygulamaya son vermeyiniz. FEIBA'yı her zaman için doktorunuzun söylediği şekilde kullanınız. Emin olmadığınız her durumda doktorunuza ya da eczacınıza danışınız. -Uygulama yolu ve metodu:FEIBA, ambalajı içindeki çözücüsü ile sulandırıldıktan sonra damar içine (intravenöz) uygulanır. İlacınız doktorunuzun size uygun gördüğü doza bağlı olarak, vücut ağırlığınızın her bir kilogramıbaşına dakikada 2 Üniteden hızlı olmayacak bir sürede damardan uygulanacaktır. Gerekirse uygulama öncesi ürün oda sıcaklığı veya vücut ısısına getirilmelidir. FEIBA, kullanmadan hemen önce sulandırılarak uygulanır. Koruyucu madde içermediğinden sulandırılarak kullanıma hazır hale getirilmiş çözelti hemen kullanılmalıdır. Bütün içerik çözünene kadar yavaşça çalkalayınız. FEIBA'nın tamamen çözünmüş olduğundan emin olunmalıdır; aksi takdirde cihazın filtresinden daha az etkin madde geçer. 7Sulandırıldıktan sonra bulanık olan ya da tortu içeren çözeltiler kullanılmamalı ve uygun bir şekilde imha edilmelidir. Sulandırıldıktan sonra 25°C'nin altındaki oda sıcaklığında 3 saat dayanıklıdır. Sulandırılmış çözelti buzdolabında saklanmamalıdır. Ambalajı açılmış ürün yeniden kullanılmamalıdır. Yalnızca ambalajı içindeki enjeksiyonluk su ve cihazı kullanarak sulandırınız. Ambalajı içindeki cihaz dışında başka bir cihazla kullanılacaksa, en az 149 mikrometre çaplı uygun bir filtre kullanıldığından emin olunuz. Steril bariyeri bozulan, ambalajı hasar görmüş ya da bozulma belirtisi gösteren ürünü kullanmayınız. Uygulamayı yapacak sağlık personeli için ilacınızı hazırlama ve uygulama talimatı bu Kullanma Talimatı'nın sonunda yer almaktadır. -Değişik yaş grupları:Çocuklarda kullanımı:6 yaş altı çocuklardaki kullanımıyla ilgili deneyim yetersizdir. Çocuklarda klinik duruma göre erişkinlerdeki aynı doz şeması doktorunuzca belirlenecektir. Yaşlılarda kullanımı:FEIBA'nın yaşlılarda kullanımı ile ilgili yalnızca kısıtlı klinik çalışma verileri bulunmaktadır. -Özel kullanım durumları:Böbrek ve karaciğer yetmezliği:Böbrek yetmezliğinde kullanımına ilişkin yeterli veri bulunmamaktadır. Karaciğer fonksiyon testleri bozulmuş olan hastalarda aktive olmuş pıhtılaşma faktörlerinin vücuttan temizlenmesinin gecikmesinden dolayı yaygın damar içi pıhtılaşma (DIC) gelişimi riskiartar. Eğer FEIBA'nm etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.Kullanmanız gerekenden daha fazla FEIBA kullandıysanız:Kullanmanız gerekenden daha fazla FEIBA kullandıysanız hemen doktorunuzu haberdar ediniz. FEIBA'nın aşırı dozda kullanımı tromboembolizm (kan damarları içinde pıhtı oluşarak oluşan bu pıhtıların daha küçük damarları tıkaması), yaygın damar içi pıhtılaşma ya da kalp krizi (miyokard infarktüsü) gibi istenmeyen etkilerin görülme riskini arttırır. Bu istenmeyen etkilerin görüldüğü 8tromboemboli olgularının (damarın kan pıhtısı tarafından tıkanma durumu) bazılarında vücut ağırlığının kg'ı başına 200 üniteden yüksek dozların kullanıldığı ya da hastaların tromboembolizmaçısından riskli oldukları bildirilmiştir. Uygulama sırasında sizde aşırı dozda kullanımla ilgili bu işaretler ya da belirtiler gözlendiğinde, uygulamaya derhal son verilerek uygun tedavisi yapılacaktır. FEIBA'dan kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.FEIBA'yı kullanmayı unutursanız:Unutulan dozları dengelemek için çift doz almayınız.FEIBA ile tedavi sonlandırıldığındaki oluşabilecek etkiler:Bulunmamaktadır. 4. Olası yan etkiler nelerdir?Tüm ilaçlar gibi FEIBA'nın içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir. Aşağıdakilerden biri olursa FEIBA'yı kullanmayı durdurunuz ve DERHAL doktorunuza bildiriniz veya size en yakın hastanenin acil bölümüne başvurunuz:- Aşırı duyarlılık reaksiyonları ya da alerjik reaksiyonlar (deride ve iç organlarda şişlik(anjiyoödem), uygulama bölgesinde yanma, batma, titreme, sıcak basması, ateş, deride kızarma,deri döküntüsü, baş ağrısı, kaşıntı, solunum zorluğu, göğüste sıkışma hissi, genel bir keyifsizlikdurumu, bulantı, huzursuzluk, kalp çarpıntısı, göğüste sıkışma hissi, karıncalanma, kusma,hırıltılı solunum, baş dönmesi/sersemlik hali, deride şişme, mide bağırsak (gastrointestinal)sisteminde sorunlar, bronşlarda kasılma/daralma durumu, yüksek tansiyon ve düşük tansiyon) - Anafilaksi tepkileri (deride kabarıklıklar, yüzde ve deride kızarma, dudakta/dilde/boğazdaşişme, kaşıntı, yanma, düşük tansiyon gibi ani ortaya çıkan ve potansiyel olarak hayatı tehditeden alerjik reaksiyonlar) (şok dahil) Bunların hepsi çok ciddi yan etkilerdir. Eğer bunlardan biri sizde mevcut ise, sizin FEIBA'ya karşı ciddi alerjiniz var demektir. Acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerek olabilir. Daha önce, 150 günden fazla Faktör VIII tedavisi almış hastalarda inhibitör gelişimi riski yaygın olmayan (1/100'den az)dır. Bu durumda, sizin veya çocuğunuzun ilacı istenilen etkiyioluşturmayabilir ve siz veya çocuğunuzda geçmeyen kanama meydana gelebilir. Bu durumda,derhal doktorunuzla iletişime geçiniz. Yan etkileri değerlendirmede şu sıklık sınıflaması kullanılmıştır: Çok yaygın :10 hastanın en az 1'inde görülebilir. 910 hastanın birinden az, fakat 100 hastanın birinden fazla görülebilir. Yaygın Yaygın olmayan Seyrek 100 hastanın birinden az, fakat 1000 hastanın birinden fazla görülebilir. 1000 hastanın birinden az, fakat 10.000 hastanın birinden fazla görülebilir.10.000 hastanın birinden az görülebilir. Eldeki verilerden hareketle tahmin edilemiyor. Çok yaygın:- Faktör VIII inhibisyonu (HTGH)* Yaygın:- Aşırı duyarlılık (alerjik reaksiyonlar) - Baş ağrısı - Baş dönmesi / sersemleme - Düşük tansiyon - Deri döküntüsü - Hepatit B yüzey antikor düzeyinin pozitifleşmesi Yaygın olmayan:- Faktör VIII inhibisyonu (TGH)* Bilinmiyor:- Yaygın damar içi pıhtılaşma (DIC) - Anamnestik yanıt (inhibitör düzeyinde yükselme) - Anafilaksi tepkileri (deride kabarıklıklar, yüzde ve deride kızarma, dudakta/dilde/boğazdaşişme, kaşıntı, yanma, düşük tansiyon) - Ürtiker (kurdeşen; tüm vücutta kaşıntılı kabarıklıklar) - Hipoestezi (kollar ve bacaklarda hissizlik) - Parestezi (hissizlik ya da anormal his) - Trombolik inme, embolik inme (pıhtı tıkamasına bağlı felç durumu) - Somnolans (uykuya meyil) - Disguzi (tat alma bozukluğu) - Miyokard infarktüsü (kalp krizi) - Taşikardi (kalbin normalden hızlı çalışması) - Embolizm, tromboembolik komplikasyonlar, venöz ve arteriyel tromboz (damar içindepıhtı oluşumu ve bu pıhtıların damarları tıkaması) - Hipertansiyon (yüksek tansiyon) 10- Yüz ve boyunda kızarma - Pulmoner embolizm (damar içinde oluşan pıhtıların akciğerlerdeki damarları tıkaması) - Bronkospazm (soluk yollarının daralması) - Hırıltılı solunum - Öksürük - Dispne (zorlu soluk alıp verme) - Kusma - İshal - Karında rahatsızlık hissi - Bulantı - Yüzde hissizlik - Anjiyoödem (yüzde, dilde ve dudaklarda şişme) - Kaşıntı (pirurit) - İlacın uygulandığı bölgede ağrı - Genel keyifsizlik hali - Sıcaklık hissi - Titreme - Ateş - Göğüs ağrısı - Göğüste rahatsızlık hissi - Kan basıncında düşme * HTGH (Daha önce hiç tedavi görmemiş hastalar) klinik çalışmalarında rapor edilmiştir. TGH'de (Daha önce tedavi görmüş hastalar) rapor edilmiştir. Hızlı intravenöz infüzyon kan basıncında bir düşme yanında bıçak saplanır gibi bir baş ağrısı ile yüzde ve bacaklarda hissizliğe neden olabilir. Maksimum günlük dozun üzerindeki dozların kullanımından ve/veya uzun süreli uygulamalardan sonra ve/veya tromboembolik olaylar açısından risk faktörü olan hastalarda kalp krizi (miyokardinfarktüsü) gözlenmiştir. Yan etkilerin raporlanmasıKullanma Talimatında yer alan veya almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yan etkileriwww.titck.gov.tr sitesinde yer alan İlaç Yan Etki Bildirimi ikonuna tıklayarak ya da 0 800 31400 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi (TÜFAM)'nebildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacın güvenliliği hakkında 11daha fazla bilgi edinilmesine katkı sağlamış olacaksınız. Eğer bu kullanma talimatında bahsi geçmeyen herhangi bir yan etki ile karşılaşırsanız doktorunuzu veya eczacınızı bilgilendiriniz.5.FEIBA'nın saklanmasıFEIBA'yı çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız.FEIBA'yı 25°C'nin altındaki oda sıcaklığında saklayınız. Dondurmayınız. Rekonstitüye edildikten sonra (sulandırıldıktan sonra) kullanıma hazır hale getirilmiş çözelti 25°C'nin altında saklanmak koşuluyla 3 saat içerisinde kullanılmalıdır. Rekonstitüye edilmişçözelti buzdolabında saklanmamalıdır. Işıktan korumak için orijinal ambalajında saklayınız. Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz. Son kullanma tarihiyle uyumlu olarak kullanınız.Son kullanma tarihi o ayın son gününü ifade eder. Kutu üzerinde yazan son kullanım tarihinden sonra FEIBA'yı kullanmayınız.Ruhsat sahibi: Üretim yeri:Takeda İlaç Sağlık Sanayi Ticaret Limited Şirketi Levent-Şişli/İSTANBUL Baxter AG, Viyana Avusturya Bu kullanma talimatı en son tarihinde onaylanmıştır.12AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR.Tedavi koagülasyon bozuklukları konusunda uzman bir hekim tarafından başlatılmalı ve bu hekimin gözetiminde devam ettirilmelidir. Dozaj bilgileri Uygulanacak dozun miktarı, zamanlaması, uygulamanın ne kadar tekrarlanacağı ve tedavinin süresi, kanamanın şiddeti, yeri ve yayılımı yanında hastanın klinik durumuna göre değişir.Dozaj ve uygulama sıklığı her olguda klinik etkililiğe göre ayarlanmalıdır. Genel olarak 50-100 Ünite/kg FEIBA dozu önerilmektedir; kanama şiddetinin daha yüksek doz kullanımını gerektirmediği durumlarda tek uygulamada 100 Ünite/kg ve günlük olarak 200Ünite/kg dozları aşılmamalıdır. Hastaya özgü faktörler nedeniyle by-pass edici ajanlara yanıt değişiklik gösterebilir ve belirli kanama durumlarında bir ajana yetersiz yanıt veren hastalar bir başka ajana yanıt verebilir. By-pass edici bir ajana yanıtın yetersiz olduğu durumlarda, başka bir ajanın kullanımıdüşünülmelidir. Pediyatrik kullanım (çocuklar)6 yaş altı çocuklardaki kullanımıyla ilgili deneyim yetersizdir. Çocuklarda klinik duruma göre erişkinlerdeki aynı doz şeması adapte edilmelidir. 1) Spontan kanamalarKas eklem ve yumuşak doku kanamaları:Küçük ve orta dereceli kanamalarda önerilen doz 12 saatlik aralarla 50-75 Ünite/kg'dır. Tedaviye, ağrının kaybolması, eklem şişkinliğinin azalması ya da hareketliliğinin kazanılmasıgibi klinik düzelme belirtileri görülene kadar devam edilmelidir. Retroperitonal kanama gibi büyük kas ve yumuşak doku kanamalarında önerilen doz 12 saatlik aralıklarla 100 Ünite/kg'dır. Mukoza kanamaları:Hasta dikkatle izlenerek (kanama bölgesi görülerek, hemotokrit ölçümleri tekrarlanarak) 6 saatte bir 50 Ünite/kg önerilir. Kanama durmazsa, günde 200 Ünite/kg'nin üzerine çıkmamayadikkat edilerek doz 100 Ünite/kg'a yükseltilebilir. Diğer ciddi kanamalar:Merkezi sinir sistemi kanamaları gibi ciddi kanamalarda 12 saatlik aralıklarla verilen 100 Ünite/kg dozu önerilir. Bazı hastalara FEIBA, belirgin klinik düzelme görülene kadar 6 saatlikaralarla uygulanabilir (Günlük en yüksek doz olan 200 Ünite/kg'lık doz aşılmamalıdır.). 132) Cerrahi girişimlerCerrahi girişimlerde başlangıç dozu olarak ameliyat öncesinde 100 Ünite/kg'lık bir doz ve ameliyattan 6-12 saat sonra 50-100 Ünite/kg'lık bir doz uygulanabilir. Postoperatif idame dozuolarak 6-12 saat aralıklarla 50-100 Ünite/kg'lık dozlar uygulanabilir; doz aralıkları ve ameliyatöncesi ve sonrası tedavinin süresi, uygulanan cerrahi girişime, hastanın genel durumuna vebireysel olarak hastada sağlanan klinik etkinliğe göre belirlenir. 200 Ünite/kg'lık maksimum günlük doz aşılmamalıdır. 3) İnhibitör gelişmiş hemofili A hastalarında profilaksi- Yüksek inhibitör titresine sahip ve başarısız olmuş ITI (İmmün tolerans tedavisi)sonrası sık kanamaları olmuş hastalarda veya ITI düşünülmeyen hastalarda kanamaprofilaksisi:Günaşırı 70-100 Ünite/kg'lık bir doz önerilmektedir. Duruma göre doz günde 100 Ünite/kg'a yükseltilebilir ya da giderek azaltılabilir. - Yüksek inhibitör titresine sahip hastalarda ITI (immün tolerans tedavisi)almaktayken görülen hastaların profilaksisi:FEIBA, faktör VIII inhibitör titresi <2 BU* (Bethesda Unit) oluncaya kadar günde iki kez 50-100 Ünite/kg dozunda ve faktör VIII uygulamasıyla eş zamanlı olarak kullanılabilir. * 1 Bethesda Ünitesi inkübe edilmiş (37°C'de 2 saat) plazmanın faktör VIII etkinliğinin %50'sini inhibe eden antikor düzeyi olarak tanımlanmıştır.4) FEIBA'nın özel hasta gruplarında kullanımıFaktör VIII inhibitörlerinin tam ve kalıcı olarak eliminasyonunu sağlamak için FEIBA, Faktör VIII konsantreleri ile kombine olarak uzun süreli tedavilerde de kullanılmıştır. Tedavinin İzlenmesiFEIBA'nın etkili olabilmesi için hastada yeterli sayıda ve fonksiyonel olarak sağlam trombosit bulunması gerektiğinden FEIBA ile yürütülen tedaviye yanıt yetersizse bir trombosit sayımıyapılması önerilir. FEIBA'nın etki mekanizmasının kompleks olmasından dolayı etkin maddenin doğrudan izlemi gerçekleştirilemez. Tam kan pıhtılaşma zamanı (WBCT), tromboelastogram (TEG, r değeri) veaPTT değerlerinde genellikle ancak az bir azalma görülür ve klinik etkililik ile korelasyongöstermeyebilir. Bu nedenle FEIBA tedavisinin izlenmesinde bu testlerin önemi düşüktür. Tek uygulamada 100 Ünite/kg'lık ve günlük olarak 200 Ünite/kg'lık dozlar aşılmamalıdır. 100 Ünite/kg'lık dozların uygulandığı hastalar dikkatle, özellikle de DIC ve/veya akut koroneriskemi semptomlarının gelişimi ve diğer trombotik veya tromboembolik olayların semptomlarıaçısından izlenmelidir. Yüksek dozlarda FEIBA ancak kesin olarak gerektiği süre boyunca - 14kanama durana kadar - kullanılmalıdır. Kan basıncı ile kalp atım hızında klinik olarak anlamlı değişiklikler, solunum zorluğu, öksürük ya da göğüs ağrısı ortaya çıkarsa infüzyon derhal durdurulmalı, uygun tanı ve tedavi metodlarıuygulanmalıdır. Fibrinojen düzeylerinde bir azalma olması, trombosit sayısında bir azalmaolması ve/veya fibrin/fibrinojen yıkım ürünlerinin (FDP) ortaya çıkması DIC açısından anlamlılaboratuvar parametreleridir. Diğer DIC göstergeleri arasında trombin zamanı, protrombinzamanı ve aPTT'nin açık bir şekilde uzaması bulunur. İnhibitörlü hemofili hastalarında veyafaktör VIII, faktör IX ve/veya faktör XI'e karşı kazanılmış inhibitörü olan hastalarda aPTT alttayatan hastalığa bağlı olarak uzayabilir. Anamnestik yanıtİnhibitörlü hastalarda FEIBA uygulanması başlangıçta inhibitör düzeylerinde anamnestik bir yükselmeye yol açabilmektedir. FEIBA uygulamaya devam edildiğinde, inhibitörler zamanlaazalabilir. Klinik ve yayınlanmış veriler FEIBA'nın etkililiğinin azalmadığını öngörmektedir. FEIBA tedavisi uygulanan inhibitörlü hemofili hastalarında veya koagülasyon faktörlerine karşı kazanılmış inhibitörleri olan hastalarda aynı zamanda kanamaya eğilim ve tromboz riskiartabilir. Laboratuvar testleri ve klinik etkililikEtkililiğin kanıtı olabilecek aPTT, tam kan pıhtılaşma zamanı (WBCT) ve tromboelastogram (TEG) gibi in vitro testlerle klinik tablonun korelasyon göstermesi şart değildir. Bu nedenle budeğerleri normale döndürmek için FEIBA dozu arttırılmamalıdır; aksine olası bir aşırı doza bağlıDIC olayını tetikleyebilme riski nedeniyle kesinlikle dozun arttırılmaması gerekir. Trombosit sayısının önemiFEIBA'nın etkili olabilmesi için hastada yeterli sayıda ve fonksiyonel olarak sağlam trombosit bulunması gerektiğinden FEIBA ile yürütülen tedaviye yanıt yetersizse bir trombosit sayımıyapılması önerilir. İnhibitör gelişmiş hemofili B hastalarının tedavisiHastalığın nadir görülüyor olması nedeniyle, faktör IX'a karşı inhibitör gelişmiş hemofili B hastalarında deneyim kısıtlıdır. FEIBA klinik çalışmalarda 5 inhibitörlü hemofili hastasındakanadıkça tedavi, profilaksi ya da cerrahi girişimde kullanılmıştır. Yüksek titreli inhibitörü bulunan hemofili A ya da B hastalarında gerçekleştirilen prospektif, randomize, açık etiketli, paralel kollu bir klinik çalışmada (090701, PROOF), 36 hasta 12 ay ±14 gün profilaksi ya da kanadıkça tedavi alacak şekilde randomize edilmiştir. Profilaksikolundaki 17 hastaya günaşırı 85 ± 15 U/kg FEIBA uygulanmış; geri kalan 19 hastaya isekanadıkça hekimin belirlediği miktarlarda FEIBA uygulanmıştır. Kanadıkça tedavi alangruptaki iki inhibitörlü hemofili B hastası ve profilaksi grubunda ise bir inhibitörlü hemofili Bhastası tedavi edilmiştir. 15Tüm kanama tipleri için ortanca ABR (yıllık kanama sıklığı) profilaksi grubunda (ortanca ABR = 7,9), kanadıkça tedavi grubuna kıyasla (ortanca ABR = 28,7) daha düşük bulunmuştur; bunagöre ortanca ABR açısından iki tedavi kolu arasında %72,5 oranında bir azalma ortayakoymuştur. FEIBA'nın perioperatif dönemde kullanıldığı bir başka prospektif girişimsel olmayan gözetim çalışmasında (PASS-INT-003, SURF) 23 hastada toplam 34 cerrahi işlem uygulanmıştır.Hastaların büyük bölümü (18 hasta) inhibitör gelişmiş hemofili A hastasıydı. Kalan hastalarınikisi inhibitör gelişmiş hemofili B hastası ve üçü inhibitör gelişmiş kalıtsal olmayan (edinsel)hemofili A hastası olmuştur. FEIBA'ya maruziyet süresi 1 ile 28 gün olmuştur (ortalama 9 gün,ortanca 8 gün). Ortalama kümülatif doz olarak 88,347 U (ortanca kümülatif doz = 59,000 U)kullanılmıştır. İnhibitör gelişmiş hemofili B hastaları için en uzun FEIBA maruziyet süresi 21gün ve uygulanan maksimum doz 7324 U olmuştur. Bu çalışmalara ek olarak faktör IX inhibitörlü hemofili B hastalarındaki kanamaların tedavi ve önlenmesi için FEIBA kullanılan 36 olgu bildirimi bulunmaktadır. Bunlardan 24'ü kanadıkçatedavide, dördü profilakside ve sekizi ise cerrahi girişim sırasında FEIBA kullanılan inhibitörlühemofili B olgularıdır. FEIBA'nın faktör X, XI ve XIII'e karşı kazanılmış inhibitörleri olan hastalarda kullanımıyla ilgili izole raporlar da bulunmaktadır. Uygulama şekliÜrünü aşağıda tarif edildiği şekilde sulandırarak kullanıma hazırlayınız ve intravenöz yoldan yavaş infüzyon yoluyla uygulayınız. Dakikada maksimum infüzyon hızı her kilogram için 2ünite'yi aşmamalıdır. Liyofilize flakonun BAXJECT II Hi-Flow cihaz kullanılarak sulandırılması:1. Gerekliyse çözücü (enjeksiyonluk su) içeren açılmamış flakonu oda sıcaklığına (15°C -25°C) kadar ısıtınız. Bu işlem için birkaç dakika süreyle ılık su banyosu (maksimum 37°C) kullanılabilir. 2 Kuru toz ve çözücü flakonlarının koruyucu kapaklarını çıkarınız ve her ikisinin de lastik tıpalarını dezenfekte ediniz. Flakonları düz bir yere yerleştiriniz. 3. BAXJECT II Hi-Flow cihazının ambalajını, ambalajdaki kağıt kapağı çekerek cihazın içinedokunmadan açınız (Şekil a). Bu noktada transfer cihazını ambalajın içinden çıkarmayınız. 4. Ambalajı ters çeviriniz ve şeffaf plastik delici kısmını çözücü flakonun tıpasına uygulayınız(Şekil b). Ambalajı kenarından tutarak BAXJECT II Hi-Flow cihazının üzerinden çıkarınız(Şekil c). BAXJECT II Hi-Flow cihazının üzerindeki mavi kapağı çıkarmayınız. 5. Çözücü flakon ve BAXJECT II Hi-Flow cihaz kombinasyonunu, çözücü flakon yukarıyagelecek şekilde çeviriniz. Diğer mor renkli plastik delici ucu, toz konsantrenin bulunduğuflakonun tıpasına uygulayınız. Çözücü vakum etkisiyle konsantrenin bulunduğu flakonuniçerisine çekilecektir (Şekil d). 6. Bütün içerik çözünene kadar yavaşça çalkalayınız. FEIBA 'nın tamamen çözünmüş 16olduğundan emin olunmalıdır; aksi takdirde, etkin madde cihazın filtresinden geçmeyecektir.
Şekil a
Şekil b
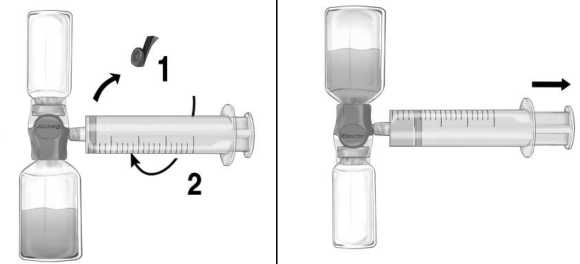
Şekil c  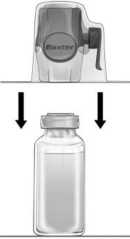  Enjeksiyon / İnfüzyon için talimatlar:Tüm prosedür boyunca aseptik teknik kullanınız. 1. BAXJECT II Hi-Flow cihazındaki mavi koruyucu kapağı çıkarınız. Enjektörü BAXJECT II Hi- Flow cihazına iliştiriniz (ENJEKTÖRE HAVA ÇEKMEYİNİZ) (Şekil e). Ürününenjektör ve BAXJECT II Hi-Flow cihazına iliştiğinden emin olmak için, bir luer kilitlienjektör kullanımı önemle tavsiye edilir. (Birleştirirken dur pozisyonuna kadar enjektörüsaat yönünde çeviriniz.) 2 Bileşkeyi ters çeviriniz (FEIBA flakonu üstte kalacak şekilde). Pistonunu yavaşça geriye doğru çekerek FEIBA çözeltisini enjektöre çekiniz ve çekme sırasında ürünün enjektör veBAXJECT II Hi-Flow cihazı arasındaki bağlantının sağlandığından emin olunuz (Şekil f). 3. Enjektörü çıkarınız. 4. Enjektörde ürün içinde köpük meydana gelirse, köpük geçene kadar bekleyiniz.Enjektördeki çözeltiyi kelebek infüzyon seti (ya da tek kullanımlık iğne) ile yavaşçaintravenöz enjeksiyon şeklinde uygulayınız.
Şekil d
Şekil e
Şekil f
 Dakikada maksimum infüzyon hızı her kilogram için 2 ünite'yi aşmamalıdır.17 |
İlaç BilgileriFeiba 500 U Iv İnfüzyon İçin Liyofilize Toz İçeren FlakonEtken Maddesi: Faktör Viii İnhibitör By-pass Aktivitesine Sahip İnsan Plazma Proteini Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
